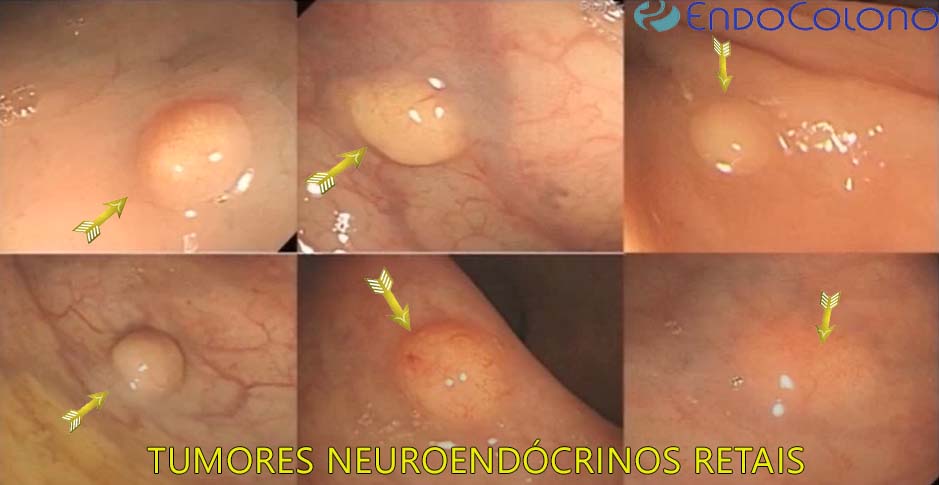
Tumores neuroendócrinos retais (TNER) (carcinoides retais) são tumores raros, mas a prevalência está aumentando constantemente devido ao aumento da expectativa de vida e aumento da incidência relacionada ao número crescente das colonoscopias de rastreamento.
A gestão dos TNER depende da presença ou ausência dos fatores preditivos de metástases em linfonodos, incluindo tamanho do tumor, aspecto endoscópico, estágio T (profundidade de invasão da parede), grau histológico e invasão linfovascular.
Epidemiologia dos tumores neuroendócrinos retais
Diagnóstico dos tumores neuroendócrinos retais
Diagnóstico patológico dos tumores neuroendócrinos retais
Prognóstico dos tumores neuroendócrinos retais
Gestão inicial e investigação diagnóstica dos tumores neuroendócrinos retais
Técnicas de ressecção endoscópica dos tumores neuroendócrinos retais
Síntese: indicações de técnicas de ressecção em pacientes com tumor neuroendócrino retal
Vigilância após ressecção dos tumores neuroendócrinos retais
Conclusões sobre o manejo endoscópico dos tumores neuroendócrinos retais
TNE do intestino delgado (aproximadamente 1,2/100.000).
A incidência anual de TNER tem aumentado gradualmente nas últimas décadas, de 0,15/100.000 em 1985 para 1,2/100.000 em 2012. Este aumento na incidência pode ser devido ao aumento do número de colonoscopia de triagem realizadas, detecção endoscópica aprimorada, melhor consciência clínica e relatório mais sistemático nos registros.
Fatores de risco significativos de TNER são gênero masculino, história pessoal anterior de malignidade, consumo de álcool, diabetes e dislipidemia (baixo nível de colesterol de lipoproteína de alta densidade e hipertrigliceridemia.
Finalmente, TNER ocorre predominantemente durante a sexta década, provavelmente porque corresponde à idade em que os programas de colonoscopia de rastreamento predominam.
Metástases linfonodais (MLN) e metástases à distância são raramente encontradas no momento do diagnóstico, sendo responsáveis por 2% e 8% respectivamente. A taxa de pacientes com sintomas no diagnóstico é altamente variável entre as séries, mas varia de 10 a 15%. Os sintomas mais frequentemente presentes no diagnóstico inclui hematoquezia e alteração do hábito intestinal.
O aspecto endoscópico do TNER é geralmente como pequena lesão subepitelial no reto inferior ou médio. A maioria são polipoides (elevadas), arredondadas e com coloração amarelada (31% dos casos). Metade mede menos que 5 mm, enquanto as lesões medindo 11 e 19 mm ou > 20 mm representam aproximadamente 8% cada. Uma proporção limitada (<10%) de TNER pode apresentar depressão central ou úlcera.
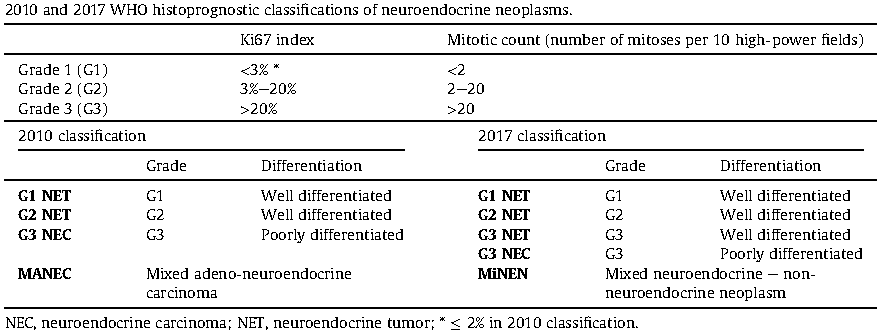
O grau histo-prognóstico é essencial para a caracterização prognóstica e decisão terapêutica. A classificação da OMS de 2017 subdividiu a categoria de alto grau (G3) em TNE bem diferenciada e mal diferenciada.
Estágio do tumor neuroendócrino retal
O estágio do tumor é o principal fator prognóstico dos TNEs retais. TNER deve ser classificado de acordo
a 8ª edição da classificação TNM, que se aplica apenas a TNER bem diferenciado. O carcinoma pouco diferenciado deve ser classificado como o adenocarcinoma retal.
A taxa de sobrevida específica da doença em 5 anos é de 99,3%, 96,7% e 44,1%, para pacientes com TNERs local, com comprometimento de linfonodo regional e com metástase a distância, respectivamente.
A maioria dos TNERs são limitados à submucosa, embora 8% e 19% deles possam invadir a muscular própria (T2). O estágio T2 está associado a um aumento independente do risco de metástase linfonodal.
Classificação UICC Tumor-Node-Metastases de TNER, 8ª edição.
TX – O status do tumor primário não pode ser avaliado
T0 – Sem evidência de tumor primário
T1a – Invade a lâmina própria ou submucosa e tamanho <1 cm
T1b – Invade a lâmina própria ou submucosa e tamanho 1 e 2 cm
T2 – Invade a lâmina própria ou submucosa e tamanho >2 cm ou invade muscular própria
T3 – Invade o tecido subseroso sem invadir a serosa
T4 – Invade o peritônio ou outros órgãos
NX – Status do linfonodo regional não avaliável
N0 – Sem metástase de linfonodo regional
N1 – Metástases de linfonodos regionais
Mx – Status metastático não avaliável
M0 – Sem metástase distante
M1 – Metástases distantes
M1a – Metástase hepática apenas
M1b – Metástase extra-hepática apenas
M1c – Metástases hepáticas e extra-hepáticas
Tamanho do tumor neuroendócrino retal
Entre 70% e 85% do TNERs tem um tamanho <10 mm quando diagnosticados. O risco de metástases é muito baixo (<3%) em TNER <10 mm e muito alto (30% e 80%) em >20 mm de tamanho. Entre esses dois extremos, 4% e 20% dos pacientes com TNER medindo entre 10 e 19 mm têm metástases sincrônicas ou metacrônicas.
Características endoscópicas atípicas do tumor neuroendócrino retal
Características endoscópicas atípicas (hiperemia, erosões, depressão e ulcerações) são relatadas em 6% a 22% de TNERs. Embora os dados da literatura sejam controversos, tais atipias são mais frequentes nos tumores maiores quando o risco de metástases linfonodais é aumentado.
Grau de histológico e prognóstico do tumor neuroendócrino retal
A grande maioria dos TNER são G1. Entre 2% e 13% dos TNER são classificados como G2 ou G3 quando existe um risco significativamente aumentado de metástases em comparação com G1 TNER.
São descritas taxas de MLN de 6% e 75% no G1 e G2 TNER, respectivamente.
Invasão linfovascular (ILV) tem sido frequentemente, mas inconstantemente, relatado como um fator de prognóstico em TNER, porque sua avaliação sofre variações interobservador e porque existem duas metodologias. ILV está correlacionada com o tamanho do tumor em vários estudos, mas a especificidade pode não ser ideal para prever a existência de metástase linfonodal.
Status das margens de ressecção do tumor neuroendócrino retal
As margens de ressecção de TNEs retais após a ressecção endoscópica às vezes são positivas nos exames de anatomopatológico. No entanto, a positividade da margem de ressecção não é totalmente preditiva de tumor residual nem recidiva, uma vez que a destruição das células tumorais vizinhas pela cauterização durante a ressecção endoscópica pode esterilizar o local da ressecção.
De fato, em quatro séries analisadas juntas, quando foi realizada ressecções de toda a espessura da parede retal pela microcirurgia endoscópica transanal (TEM) ou cirurgia radical após ressecção endoscópica incompleta, tumor residual foi detectado em apenas 26 dos 104 pacientes (25%).
Sendo assim, um estado R1 determinado patologicamente (margens positivas) pode resultar em desnecessário (e potencialmente mórbido) sobretratamento cirúrgico. No entanto, a ressecção R1 não pode ser considerada como curativa e terapia complementar deve ser discutida. A estratégia mais preconizada consiste em realizar biópsias na área da ressecção antes de considerar um tratamento de resgate adicional.
O TNE retal pode ser diagnosticado apenas no anatomopatológico após a ressecção endoscópica de um pólipo retal duvidoso por polipectomia convencional ou mucosectomia que pode não atingir margens de ressecção suficientes. Os fatores preditivos de metástase linfonodal e recorrência local devem ser avaliados para decidir se um tratamento adicional de resgate deve ser realizado e qual é o mais apropriado.
Uma lesão ou pólipo retal com suspeita endoscópica de TNE pode ser biopsiada (idealmente, realizar biópsias superficiais) e fotografada quando maiores que 2 cm e/ou com superfície irregular ou apenas documentada sugerindo exames de imagem para melhor definição. Em ambos os casos um exame adequado de imagem deve ser realizado para avaliar o risco de metástases e grau de invasão da parede retal para que o tratamento mais adequado seja determinado.
O reconhecimento ou suspeita de TNER durante a colonoscopia é, portanto, de grande importância, pois permite evitar algumas ressecções inadequadas e fazer um plano para a ressecção endoscópica adequada no primeiro procedimento, aumentando as chances de ressecção curativa.
EUS endorretal dos tumores neuroendócrinos retais
A ultrassonografia endoscópica endorretal (USE) tem alto desempenho diagnóstico para TNER, incluindo valores preditivos positivos e negativos e precisão diagnóstica de 81%, 92% e 85%, respectivamente.
No USE, o TNER geralmente tem um aspecto redondo (51%) ou nodular (32%). Seu padrão de ecogenicidade pode ser hipoecoico (19%) ou intermediário (78%) e costuma ser homogêneo. A precisão do USE para a determinar a profundidade de invasão, principalmente da muscular própria, é superior a 90%. Finalmente, USE deve avaliar os linfonodos regionais, a fim de identificar sinais de possível malignidade, embora a penetração do ultrassom seja muito limitada para examinar todo o espaço perirretal.
Portanto, USE deve ser parte da investigação inicial de todos os TNEs retais, com exceção daqueles <5 mm que geralmente são ressecados na totalidade pela colonoscopia e não existe risco de metástase em linfonodo.
Finalmente, a colonoscopia completa é obrigatória para todos os pacientes com TNER para excluir câncer de cólon concomitante e outra NEN colorretal, que pode ocorrer em até 8% dos casos.
Imagem transversal pélvica (ressonância magnética e tomografia computadorizada)
Os objetivos da ressonância magnética da pelve (MRI) são avaliar o estágio T, a extensão perirretal e
envolvimento de linfonodos regionais. No entanto, os critérios de suspeita de linfonodo mesorretal são
mal definidos.
No geral, a ressonância magnética é clinicamente relevante para avaliação da infiltração da parede, especialmente em caso de TNER> T1 (muscular própria) e suspeitar de MLN no caso de linfonodos aumentados (>3 mm). Portanto, é recomendável realizar a ressonância magnética pélvica ou tomografia computadorizada como parte da investigação inicial de todo TNER >10 mm. No entanto, na ausência de linfonodos aumentados (>3 mm), a MLN não pode ser descartada e, portanto, a tomada de decisão terapêutica deve levar em consideração os outros fatores preditivos de MLN.
Avaliação à distância: imagens morfológicas e isotópicas convencionais
Explorações adicionais são justificadas para todos os TNER >20 mm de tamanho, no caso de MLN ou fatores de alto risco de MLN. Deve incluir TC torácico-abdominal-pélvica com contraste, ressonância magnética do fígado e PET-CT (imagem isotópica do receptor de somatostatina (tomografia com emissão de pósitrons).
Devido ao seu aspecto tipicamente hipervascular, as metástases associadas a TNER geralmente aumentam após injeção de contraste na fase arterial, com eliminação na fase portal. Ressonância magnética especialmente com sequências de difusão ponderada tem melhor sensibilidade do que tomografia computadorizada e PET-CT com receptor de somatostatina para a detecção de lesões à distância, especialmente metástases hepáticas.
A maioria dos TNER apresentam receptores de somatostatina e, portanto, são identificados pela cintilografia do receptor de somatostatina (Octreoscan®) ou tomografia de emissão de pósitrons de gálio 68. Este último deve ser preferido por ter maior afinidade e resolução espacial, requer menor tempo e expõe o paciente a menos radiação. A imagem do receptor da somatostatina permite identificar metástases à distância com excelente sensibilidade.
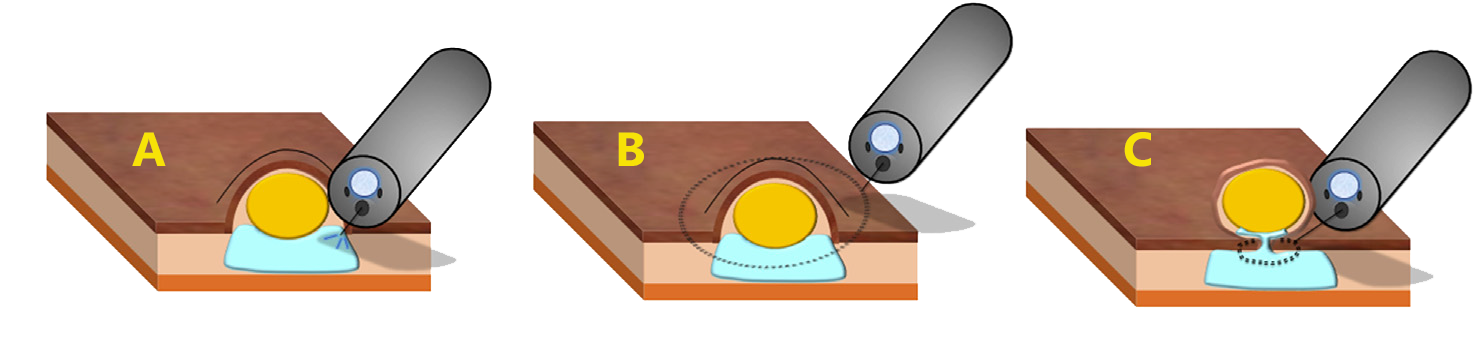
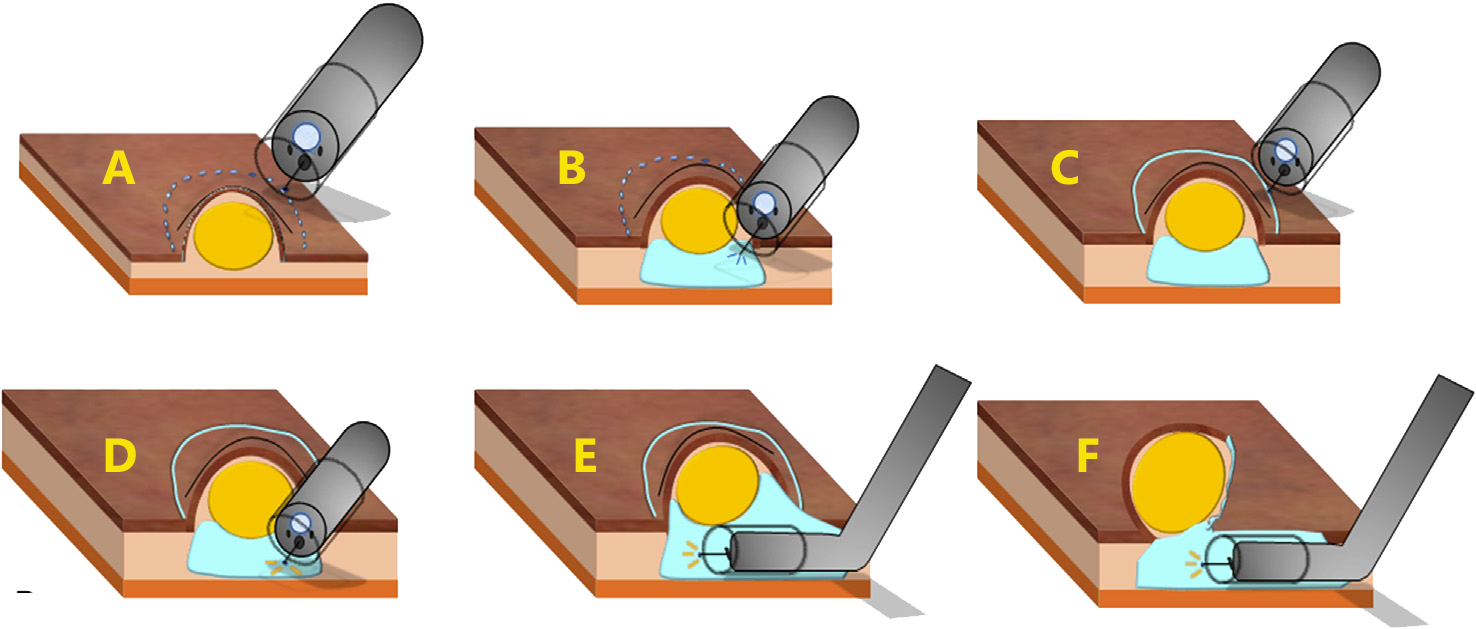
Polipectomia e mucosectomia (ressecção endoscópica da mucosa [EMR]) consistem na ressecção com alça do TNER, realizada sem ou com injeção inicial de solução salina na submucosa (que visa reduzir os riscos de perfuração e margens de ressecção verticais incompletas), respectivamente. Deve-se evitar as ressecções em fragmento por limitar a qualidade do exame patológico e aumenta o risco de ressecção incompleta. Essas técnicas de ressecção padrão apresentam taxa de R0 de 59% em TNER >10 mm.
.
Técnica de ressecção endoscópica da mucosa (EMR) / mucosectomia do tumor neuroendócrino retal
A área de polipectomia ou da mucosectomia deve ser marcada após a ressecção para facilitar a localização futura e terapia de resgate no caso de as margens serem positivas. Se a marcação não foi realizada durante a polipectomia e as margens estiverem invadidas, deve-se fazer com urgência nova retoscopia para marcar o local antes da tentativa de ressecção de resgate curativa.
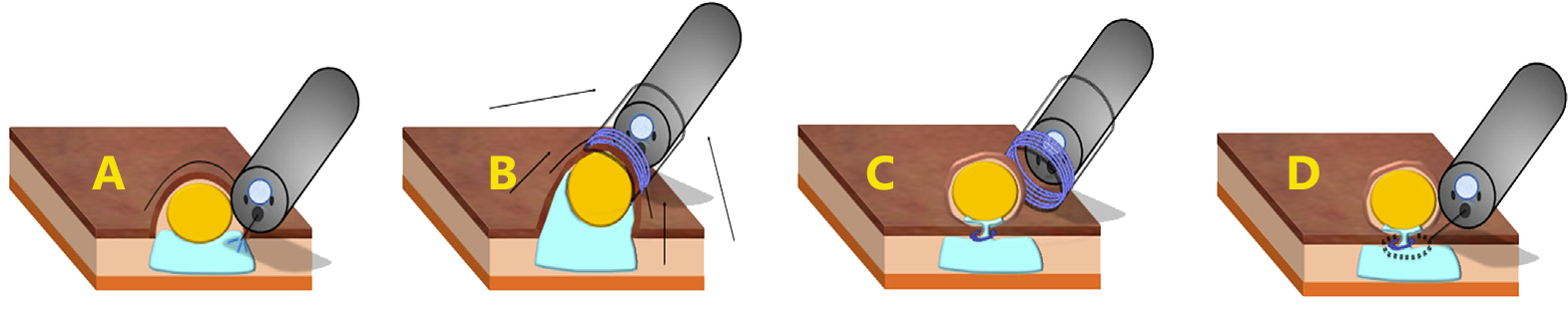
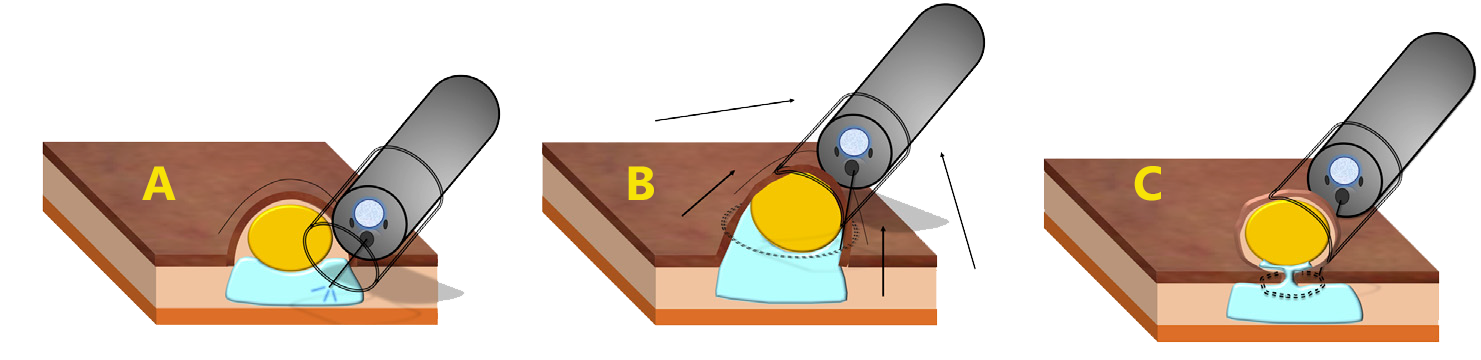
A ressecção endoscópica da submucosa assistida por ligadura (EMR-L) é descrita a fim de melhorar a eficácia da remoção endoscópica.
Técnica de ressecção endoscópica da submucosa assistida por ligadura elástica (EMR-L)
.
Mais recentemente, o uso de dissecção endoscópica da submucosa (ESD) tem sido cada vez mais relatado para TNER, mas apresenta um risco maior de perfuração e sangramento retal do que outras técnicas. Curiosamente, as taxas de ressecção incompleta e complicações são relatadas em 71% e 78%, respectivamente, ao longo de um período de 5 anos. Portanto, ESD requer habilidade específica, experiência, maior tempo operatório e só deve ser realizado em centros especializados.
As comparações entre as técnicas de ressecção endoscópica são limitadas, porque os estudos são poucos, heterógenos, quase todos retrospectivos e com acompanhamento limitado.
Em uma metanálise anterior de 25 estudos incluindo 1.094 pacientes, relataram que a EMR-L e ESD foram as técnicas mais eficazes, com respectivas taxas R0 médias de 94,8% e 89,6% (vs. 59,1% e 72,4% para polipectomia e EMR, respectivamente) e taxas de recorrência muito baixas, mas com acompanhamento limitado (<5 anos).
Da mesma forma, outra metanálise de 14 estudos comparativos (782 pacientes), relataram que a EMR-L e ESD alcançaram ressecção completa significativamente maior do que EMR simples, mas sem diferença entre elas.
Sobre TNER <10 mm, estudos mais recentes relataram eficácia semelhante de ESD e EMR-L., No entanto, uma metanálise que reagrupou 7 estudos (386 pacientes) relatou que EMR-L alcançou maior taxa de R0 do que ESD (96,1% vs. 83%) para TNER <10 mm. Além disso, ESD demorou significativamente mais tempo operatório e tendeu a causar mais complicações (p ¼ 0,11).
Portanto, EMR-L parece ser a técnica mais apropriada de ressecção endoscópica de TNER <10 mm.
Os dados são mais limitados em relação aos TNER >10 mm. EMR-L requer aspiração para o interior do aplicador de elástico, o que pode ser mais difícil neste cenário. Por outro lado, a taxa R0 da ESD mostrou não ser diferente nos TNER >10 mm quando comparados aos TNER >10mm.
A Técnica ESD parece ser a técnica mais adequada para ressecção endoscópica de TNER >10 mm.
Terapia endoscópica de resgate após polipectomia incompleta do tumor neuroendócrino retal
A ressecção endoscópica induz fibrose com endurecimento do tecido subjacente, o que pode fazer futura EMR de resgate mais difícil e menos bem sucedido. O EMR-C adjuvante atingiu 100% de margens de ressecção livres em várias séries reagrupando 43 pequenos TNER ressecados incompletamente por polipectomia e EMR.
No geral, EMR-C e ESD são viáveis para tratamento adjuvante após ressecção endoscópica primária incompleta, especialmente para TNER <10 mm. No entanto, estudos confirmatórios são necessários para confirmar as eficácias. Além do mais, a ESD não foi adequadamente comparada à microcirurgia endoscópica transanal (TEM) no contexto da terapia de resgate. Este último poderia alcançar melhores resultados, especialmente para TNER >10 mm.
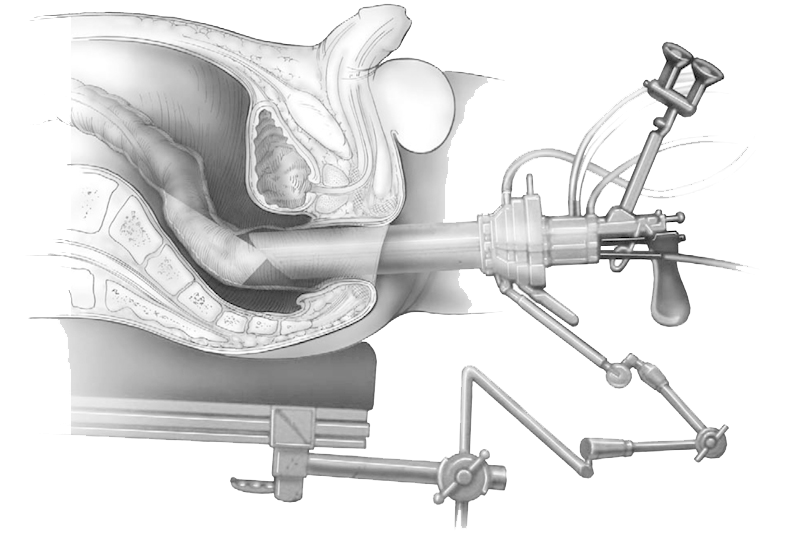 Princípios do TE. TEM é uma técnica cirúrgica minimamente invasiva que requer equipamento específico, consistindo em um porta multicanal descartável posicionada transanalmente, controlando continuamente a pressão endoluminal retal e permitindo o uso combinado de um retoscópio rígido com visão tridimensional ampliada e uso instrumentos endocirúrgicos.
Princípios do TE. TEM é uma técnica cirúrgica minimamente invasiva que requer equipamento específico, consistindo em um porta multicanal descartável posicionada transanalmente, controlando continuamente a pressão endoluminal retal e permitindo o uso combinado de um retoscópio rígido com visão tridimensional ampliada e uso instrumentos endocirúrgicos.A vantagem do TEM sobre as técnicas endoscópicas é a ressecção de espessura total de grandes lesões,
daí resultando uma taxa teórica de ressecção completa de 100%. É particularmente relevante para lesões da porções baixas ou intermediárias do reto, onde pode evitar a necessidade de ressecção segmentar
cirurgia e suas morbidades associadas para lesões passíveis de excisão local.
O TEM se tornou o técnica de ressecção de referência para lesões retais malignas T1 (sm1-2), como uma alternativa para ESD.
Estudos sobre os resultados de TEM nos TNERs são limitados e heterogêneos. Três séries relataram um total de 107 TNERs tratados por TEM, que alcançaram uma taxa de R0 de 100%, enquanto duas outras séries relataram margens R1 em 3/16 e 2/23 pacientes, respectivamente. A taxa de recorrência foi muito limitada, embora a duração do acompanhamento fosse frequentemente curta. A média de internação hospitalar é geralmente de 2 a 3 dias e os eventos adversos mais frequentes são retenção aguda de urina (até 20%), dor anal pós-operatória e sangramento ocasional.
O TEM parece muito apropriado para ressecção de resgate após excisão endoscópica incompleta, com
resultados tão favoráveis quanto à ressecção primária. De fato, quatro séries relataram uma taxa de ressecção R0 de 100% em 68 pacientes no total, em que TEM foi realizado após polipectomia incompleta, sem notável morbidade.
O TEM requer experiência, embora a curva de aprendizado relacionada possa ser relativamente curta, com um estudo estimando que um mínimo de 10 casos é necessário para um cirurgião ser proficiente com esta técnica. Ainda assim, o TEM não é amplamente aplicável e deve ser reservado a centros especializados.
No geral, o TEM parece eficaz e seguro para TNERs <20 mm com características típicas, evitando a necessidade de extensas ressecções cirúrgicas.
Cirurgia radical, incluindo abordagem laparoscópica e transabdominal
Princípios da cirurgia radical para RNET
A cirurgia retal radical com linfadenectomia deve ser discutida em todos os casos de TNERs com suspeita ou com alto risco de metástase linfonodal (LNM). Para esses pacientes, é recomendável realizar a ressecção anterior baixa oncológica (LAR) com excisão mesorretal total (TME). Por analogia com o câncer retal, a cirurgia laparoscópica se tornou a abordagem cirúrgica padrão porque alcança melhores resultados de curto e longo prazo em comparação com a cirurgia transabdominal.
Selecionar os pacientes para a cirurgia com base nos critérios propostos acima parece apropriado e conveniente, pois pode identificar adequadamente os pacientes com metástase linfonodal. Os resultados a longo prazo são favoráveis, com uma taxa de R0 de 100% em pacientes não metastáticos e muito baixo taxa de recorrência (3% e10% após um acompanhamento de 42-68 meses). A cirurgia laparoscópica radical não parece menos eficaz nem mais tecnicamente difícil no caso de ressecção endoscópica incompleta anterior, portanto, é um procedimento de terapia de resgate apropriado.
✓ TNER <15 mm de tamanho sem característica desfavorável estão associados a um risco muito baixo de LNM e podem ser ressecados adequadamente por excisão local. A polipectomia ou mucosectomia padrão não deve ser realizada na suspeita de TNER ou quando realizada deve sempre marcar o local de ressecção.
✓ Se o tamanho do tumor for <10 mm, a mucosectomia assistida por ligadura (EMR-L) aparece como a técnica endoscópica mais apropriada, quando atinge taxas de ressecção completa em mais de 95% dos casos.
✓ Em relação ao TNER medindo 10 a 15 mm, as duas técnicas mais relevantes parecem ser ESD e
TEM, que pode ser superior ao EMR-L, embora não tenham sido comparados de forma adequada. Na ausência de comparação prospectiva, ambos podem ser realizados neste indicação, dependendo da experiência local.
✓ Em caso de ressecção incompleta após a ressecção endoscópica inicial, atualmente não está claro
se a terapia de resgate é necessária, mas em caso afirmativo, TEM e ESD aparecem como a tecnologia mais apropriada, com TEM provavelmente sendo preferível no caso de tamanho do tumor > 10 mm e/ou margem de profundidade incompleta.
✓ TNER associado a fatores preditivos de LNM. TNER > 15 mm de tamanho, e/ou aqueles com características desfavoráveis, são bons candidatos para cirurgia radical com linfadenectomia. No entanto, em pacientes com comorbidades, os riscos associados a a cirurgia radical pode superar seus benefícios. Neste cenário, ESD ou TEM podem ser considerados, embora não permita o reconhecimento do status do linfonodo, portanto, o acompanhamento deve ser adaptado com intervalos mais curtos.
Retoscopia flexível de vigilância em 1 ano, 3 anos e a cada 5 anos. A vigilância é recomendada por analogia com o câncer retal.
✓ TNER ≥ 10 mm ou com ressecção endoscópica com características desfavoráveis ou ressecção R1 sem terapia de resgate:
Retoscopia flexível e ultrassom endoscópico a cada 6 a 12 meses por pelo menos 5 anos.
Biópsias sistemáticas da área de ressecção, se identificada, durante a retoscopia flexível pode ser relevante para detectar recidiva local precoce, mas isso ainda não foi avaliado.
Ressonância magnética abdominal e pélvica anual deve ser realizada para detectar recorrências perirretais e/ou distantes (fígado).
A duração do acompanhamento permanece desconhecida, pois os dados sobre o monitoramento a longo prazo dos TNERs são escassos. A colonoscopia total deve ser realizada a cada 5 anos.
TNERs de baixo risco pode ser tratado localmente, usando ESMR-L para lesões < 10 mm e ESD ou TEM para lesões entre 10 e 15 mm em centros especializados porque exigem técnica e experiência. Essas técnicas também são importantes no salvamento após o tratamento endoscópico de TNER de baixo risco ressecado incompletamente. Por outro lado, cirurgia radical com linfadenectomia deve ser proposta na presença de qualquer fator desfavorável.
O reconhecimento do TNER durante a colonoscopia inicial é de suma importância para a tomada de decisão da gestão apropriada. Se houver suspeita de TNER, a polipectomia padrão ou mucosectomia (EMR) não deve ser realizada, mas se for ressecada o local da ressecção deve ser tatuado.
Os principais fatores associados ao risco de metástases em linfonodos (LNM) em TNER são a invasão da muscular própria (T2), tamanho do tumor (> 15 mm), aspecto endoscópico atípico, grau de diferenciação 2 ou 3 e invasão linfovascular. A sua identificação depende da análise histopatológica especializada, US endoscópico e ressonância magnética pélvica.
.
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.