O câncer colorretal é uma neoplasia maligna que se origina no cólon, reto ou canal anal. A doença começa na camada superficial do revestimento intestinal (mucosa) e com o tempo vai atingindo as camadas mais profundas (submucosa, muscular e serosa) e outras estruturas adjacentes.
Introdução – Epidemiologia – Causas do Câncer Colorretal
Fatores de risco para o câncer do cólon e do reto
Fatores protetores para câncer colorretal
Programas de rastreamento do câncer colorretal
Sinais e sintomas do câncer colorretal (apresentação clínica)
Diagnóstico do câncer colorretal
Colonoscopia no diagnóstico do câncer colorretal
Estadiamento do câncer colorretal
Fatores prognósticos do câncer colorretal
Fatores determinantes para o prognóstico do câncer colorretal
Gerenciamento pré-operatório do câncer colorretal
Tratamento – Cirurgia Curativa
Cirurgia de acordo com a localização do câncer colorretal
Cirurgia para a câncer de reto
Cirurgia de urgência para obstrução ou perfuração
Cirurgia convencional e videolaparoscópica
Tratamento multidisciplinar do câncer colorretal
Tratamento Paliativo
Acompanhamento após o tratamento do câncer colorretal
Introdução – Epidemiologia – Causas do Câncer Colorretal
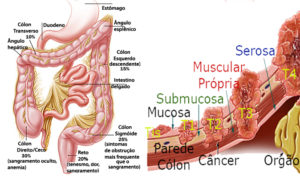 O câncer colorretal é uma neoplasia que se origina no cólon, reto ou canal anal. A doença começa na camada superficial do revestimento intestinal (mucosa) e com o tempo vai atingindo as camadas mais profundas (submucosa, muscular e serosa) e outras estruturas adjacentes.
O câncer colorretal é uma neoplasia que se origina no cólon, reto ou canal anal. A doença começa na camada superficial do revestimento intestinal (mucosa) e com o tempo vai atingindo as camadas mais profundas (submucosa, muscular e serosa) e outras estruturas adjacentes.
Epidemiologia
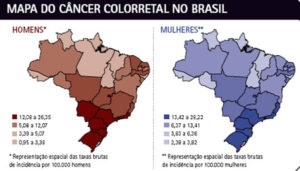 No mundo e no Brasil, o câncer colorretal é a terceira neoplasia maligna mais comumente diagnosticada e a quarta principal causa de morte por câncer.
No mundo e no Brasil, o câncer colorretal é a terceira neoplasia maligna mais comumente diagnosticada e a quarta principal causa de morte por câncer.
Para o Brasil, estimam-se 17.380 casos novos de câncer colorretal em homens e 18.980 em mulheres para cada ano. Esses valores correspondem a um risco estimado de 16,83 casos novos a cada 100 mil homens e 17,90 para cada 100 mil mulheres. O câncer colorretal é o terceiro mais frequente em homens e o segundo entre as mulheres no Sudeste. No Sudeste, esse número é cerca de duas vezes maior.
O perfil epidemiológico do Brasil e do mundo indica que a industrialização e o aumento da expectativa de vida são fatores determinantes para o aumento crescente no número de casos. Apesar dos grandes avanços relacionados à genética, exames para diagnóstico e tratamento, o câncer colorretal é frequentemente diagnosticado em uma fase tardia, a partir do aparecimento dos sinais e sintomas como sangramento digestivo, alterações do habito intestinal e emagrecimento.
Quando a sobrevida em 5 anos é drasticamente reduzida para menos de 50%. Portanto, a conscientização médica e populacional desse problema de saúde pública, seu rastreamento adequado e, consequentemente, o diagnóstico precoce são medidas fundamentais para instituir a terapêutica precoce e reduzir os índices de mortalidade.
Mais de 90% dos cânceres colorretais são diagnosticados acima dos 45 anos de idade, população alvo para os exames de prevenção ou rastreamento.
Causas do câncer colorretal – Etiopatogenia
As causas do câncer colorretal ainda não são totalmente esclarecidas. O mais aceito é que o câncer colorretal resultaria da interação entre a predisposição genética e os fatores ambientais.
A presença de alterações genéticas predisponentes é indispensável e pode ser classificado em esporádico, familiar e hereditário.
Câncer esporádico
Quando a pessoa com o câncer colorretal é o único na família, não existe outros casos. Representa a maioria dos casos de câncer colorretal. O risco na população geral acima dos 50 anos é de que 1 pessoa a cada 500 desenvolverá o câncer colorretal.
Câncer familiar
Quando já existe um parente de primeiro grau com câncer colorretal, mas não preenche os critérios para o câncer colorretal hereditário.
Caracteriza-se pela ocorrência familiar, com alta frequência de tumores múltiplos e em idade precoce. Se você tem um histórico familiar de câncer colorretal, seu próprio risco para a doença vai depender de quantos membros de sua família foram diagnosticados com câncer colorretal e em que idade. A relação é simples: Quanto mais membros da família são acometidos e quanto mais cedo a idade de diagnóstico, maior o seu risco. Aqui estão alguns exemplos básicos:
* Se você tem um irmão ou pai que foi diagnosticado com câncer de cólon, o seu próprio risco de desenvolver câncer colorretal é de cerca de 1,7 vezes maior do que se você não tenha histórico familiar.
* Se você tiver dois membros da família de primeiro grau com câncer colorretal, o risco é 2,7 vezes maior do que se você não tinha membros da família com câncer colorretal.
* O risco é ainda maior se os familiares foram diagnosticados com câncer de cólon em uma idade com menos de 60 anos.
Câncer hereditário
Síndromes genética onde é alto o risco da ocorrência do câncer colorretal.
ᴥ» Polipose Adenomatosa Familiar – FAP, quando 100% dos pacientes desenvolverão o câncer colorretal até os 40 anos se não submetidos à cirurgia para retirada de todo o cólon e reto. Pessoas com FAP têm 50% de chance de passar a condição para o seu filho. A condição pode ser passada, mesmo que o paciente tenha o seu cólon e reto removido. As crianças que não herdam a condição de seu pai não poderão passá-la para seus filhos. Cerca de um terço das pessoas com FAP não tem um dos pais acometido, portanto, tem uma mutação espontânea e podem passar FAP para os seus filhos.
ᴥ» Câncer Colorretal Hereditário Sem Polipose – HNPCC = “Hereditary Nonpoliposis Colorectal Cancer” com risco riscos cumulativos maiores para o câncer colorretal (78%) e câncer do endométrio (43%), seguido pelo trato biliar, estômago, vias urinárias e ovário (19-9%). Para os outros tipos de HNPCC, provavelmente relacionadas com o câncer, tais como intestino delgado e cérebro, o risco é apenas 1%.
Estima-se 5% a 10% dos cânceres colorretais estão associados alguma síndrome hereditária.
Dentre os diversos aspectos que reforçam a importância do papel dos fatores ambientais no câncer colorretal está a constatação das diferenças regionais em sua prevalência e incidência. É bem estabelecido que, em populações ocidentais e industrializados, a taxa de câncer colorretal é maior. Assim como a migração de residentes em áreas de baixa incidência para as de alta aumenta significantemente o risco de desenvolvimento do câncer colorretal.
Fatores de risco para o câncer do cólon e do reto
Hábitos e estilo de vida
O risco do câncer colorretal é muito maior na pessoas com dieta rica em gordura saturada e pobre em fibras e vitaminas (frutas e vegetais).
Carne processada e carne vermelha
O consumo de carne processada (salsicha, linguiça, bacon e presunto) é fator de risco certo para o câncer colorretal e carnes vermelhas (carne de boi, porco, cordeiro, vitela, carneiro, cavalo e cabra), de um modo geral, são fatores de risco “provável”. Estima que a ingestão diária de 50 gramas de carne processada aumente o risco de câncer de intestino em 18%. A recomendação é que seja ingerida até duas vezes na semana, podendo ser substituída, nos outros dias, pelas carnes brancas, ovos e outras combinações de alimentos com valor proteico semelhante, como arroz com feijão.
A obesidade, principalmente a abdominal
Avaliada pela relação cintura-quadril, está associada ao aumento no risco para o câncer colorretal. Esse risco é maior para aqueles que aumentam o peso entre a idade do adulto jovem (20 a 40 anos) e a meia-idade (40 a 65 anos) e principalmente para aqueles na categoria de maior ganho de peso.
Bebidas alcoólicas
Fortes evidências associam o aumento no risco para câncer colorretal quando a quantidade ingerida de bebidas alccólicas é moderada ou pesada, isto é, superior a 30 gramas de etanol por dia, cerca de duas doses de bebida destilada (75 ml), 2,5 taças de vinho (250 ml) e 3 copos de cerveja (1000 ml). A associação parece ser fraca com o uso limitado de álcool.
Tabagismo
O tabagismo, inclusive os fumantes passivos, é fator de risco certo para o câncer colorretal. É associado a maior incidência e mortalidade do câncer de intestino. O risco de morte pelo câncer de intestino também aumentou entre os fumantes. Tanto para a incidência quanto para a mortalidade, a associação é mais forte para o câncer do reto do que para o câncer do cólon. O tabagismo também é um fator de risco para todos os tipos de pólipos do cólon e reto. Para os pólipos adenomatosos, o risco é particularmente alto para adenomas mais avançados (isto é, ≥ 10 mm e para os com displasia de alto grau). O tabagismo também é um fator de risco para pólipos serrilhados do cólon. Por essas e várias outras razões, o tabagismo deve ser evitado, principalmente pelos sobreviventes de câncer de intestino.
Baixo nível socioeconômico
O baixo nível socioeconômico está associado a um risco aumentado para o desenvolvimento do câncer colorretal. Aumento aproximado de 30% quando comparado aos outros níveis socioeconômicos. Alguns comportamentos seriam os responsáveis pela disparidade socioeconômica: inatividade física, dieta não saudável, tabagismo e obesidade. Outro fator seria as taxas mais baixas de rastreamento. Todas as pessoas devem refletir sobre seu estilo de vida e buscar equilíbrio dentro de suas possibilidades. O resultado aparecerá, não só com relação à prevenção do câncer colorretal, mas também com relação à prevenção de doenças cardiovasculares e da obesidade, objetivando uma vida saudável.
Idade
A idade é um importante fator de risco para o câncer colorretal esporádico. O câncer colorretal é incomum antes dos 40 anos; a incidência começa a aumentar significativamente entre as idades de 40 e 50 anos, e as taxas de incidência específicas por idade aumentam a cada década subsequente.
Quanto maior a idade, maior o risco. Registros ocidentais sugerem que a frequência do câncer colorretal está aumentando no grupo abaixo de 45 anos, enquanto está diminuindo em grupos mais velhos. Decorre da maior aderência aos exames de prevenção do câncer colorretal nos pacientes acima dos 45 anos. Embora a frequência absoluta após os 45 anos permaneça muito maior.
A literatura atual sugere que mais de 86% dos pacientes diagnosticados com menos de 50 anos são sintomáticos no momento do diagnóstico e, apesar disso, apresentam um estágio mais avançado no diagnóstico e piores resultados.
História familiar de câncer colorretal
Quanto mais pessoas de uma mesma família têm câncer colorretal, maior o risco de outro membro dessa família desenvolver o câncer colorretal. Alguém com parente próximo (pai, mãe, irmão, tios ou avós) com câncer colorretal, o risco para a doença aumenta muito, especialmente se a doença acometeu um parente com menos de 40 anos de idade. Nesses casos, todos os parentes devem fazer a colonoscopia de prevenção.
Doenças hereditárias relacionadas ao câncer colorretal
Polipose Adenomatosa Familiar
ᴥ»Todos os portadores dessa polipose desenvolvem câncer colorretal até os 40 anos, se não forem submetidos a cirurgia para retirada de todo o cólon e reto.
ᴥ»Doença hereditária, com transmissão autossômica dominante, sendo assim, pessoas com FAP têm 50% de chance de passar a condição para o seu filho. A condição poderá ser passada, mesmo que o paciente tenha o seu cólon e reto removido. As crianças que não herdam a condição de seu pai não podem passá-la para seus filhos.
ᴥ»Cerca de um terço das pessoas com FAP não tem um dos pais acometido, portanto, tem uma mutação espontânea e podem passar FAP para os seus filhos. VEJA MAIS AQUI! ➡
Câncer Colorretal Hereditário Sem Polipose – HNPCC – Síndrome de Lynch (SL)
Também conhecido como Síndrome de Lynch, a HNPCC é uma doença autossômica dominante responsável por cerca de 5% a 10% do total dos cânceres colorretais. É a síndrome hereditária mais comum de predisposição ao câncer colorretal. Ainda que os critérios para diagnóstico de Amsterdam e tratamento estejam estabelecidos, o conhecimento da síndrome pela classe médica é insuficiente. Se comporta como na FAP, isto é, têm 50% de chance de passar a condição para o seu filho. Independe da atuação de fatores ambientais.
Os indivíduos com HNPCC têm uma probabilidade próxima dos 70% de desenvolver o câncer colorretal. Ocorre geralmente em idades mais jovens, os tumores localizam-se principalmente no cólon direito. Apresentam ainda, um risco aumentado de tumores extra-cólicos (TEC), principalmente carcinomas do endométrio, ovário, estômago, intestino delgado, urotélio, pâncreas e vias biliares.
Critérios de Amsterdam usado para o diagnóstico da síndrome familiar
Pelo menos três casos de câncer colorretal (CCR), que preencham os seguintes critérios:
1- Um membro seja parente em 1º grau dos outros dois.
2- Pelos menos 2 gerações sucessivas acometidas.
3- Pelo menos um dos casos de câncer colorretal diagnosticado abaixo dos 50 anos.
4- Polipose adenomatosa familiar deve ser excluída.
Os critérios de Amsterdam (CA), embora altamente específicos, têm valor muito limitado, inclusive para nossa população, pois são extremamente restritivos. Assim, foram propostos os critérios de Bethesda, menos restritivos, com o intuito de levantar a suspeita de HNPCC e a utilização de testes laboratoriais, como a instabilidade de microssatélites, para auxiliar a definir um maior número de famílias de risco para HNPCC.
Critérios de Bethesda
1- Indivíduos com câncer que preencham os critérios de Amsterdam.
2- Indivíduos com 2 cânceres relacionados com HNPCC, incluindo câncer colorretal metacrônicos e sincrônicos ou cânceres extra cólicos associados.
3- Indivíduos com câncer colorretal e um parente de 1º grau com câncer colorretal ou câncer extra cólico relacionado com HNPCC e/ou adenoma colorretal (um dos cânceres diagnosticado abaixo dos 45 anos e os adenomas abaixo dos 40 anos).
4- Indivíduos com câncer colorretal ou endometrial diagnosticado abaixo dos 45 anos.
5- Indivíduos com câncer de cólon direito com padrão histológico indiferenciado abaixo dos 45 anos.
6- Indivíduos com câncer colorretal com células em anel de sinete diagnosticado abaixo dos 45 anos.
7- Indivíduos com adenomas diagnosticados antes dos 40 anos.
8- Cânceres extra cólicos associados: endométrio, ovário, estômago, hepatobiliar, intestino delgado, células de transição da pelve renal ou ureter.
Teste Genético para HNPCC
O diagnóstico de HNPCC pode ser realizado de duas maneiras: clinicamente, através do preenchimento dos critérios de Amsterdam; e geneticamente, pela identificação de mutações decorrente da instabilidade de microssatélites (MSI), fruto da inativação das proteínas de reparo do DNA. Mutações germinativas nos genes hMLH1 e hMSH2, dois dos principais genes do complexo MMR, estão presentes em 80% a 90% dos casos de HNPCC.
Embora isso pareça simples, na prática os médicos encontram enormes dificuldades para estabelecer tal diagnóstico, seja porque não dispõem de informações familiares adequadas com relação ao histórico do paciente, seja porque o sequenciamento genético não é ainda uma realidade na prática médica.
Protocolo de rastreamento de famílias em risco para HNPCC
Seleciona as famílias através dos critérios de Bethesda, seguido da investigação genética com a execução do teste de instabilidade de microssatélites (MSI) e/ou a imunohistoquímica para proteínas dos genes de reparo do DNA em amostras do câncer ressecado por cirurgia ou colonoscopia. Uma vez que um destes testes mostra-se alterado, passa para a pesquisa de mutações por sequenciamento nos genes de reparo do DNA.
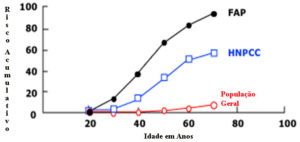 A diferenciação dos casos de HNPCC daqueles de câncer colorretal esporádico visa o aconselhamento genético, programas específicos de rastreamento e encaminhamento da família para análise mutacional no complexo MMR.
A diferenciação dos casos de HNPCC daqueles de câncer colorretal esporádico visa o aconselhamento genético, programas específicos de rastreamento e encaminhamento da família para análise mutacional no complexo MMR.
Risco acumulativo do câncer colorretal levando em conta a idade e a presença ou não das síndromes hereditárias.
Antecedente pessoal de câncer
ᴥ»Câncer de mama, ovário e útero (endométrio) – Mulheres diagnosticadas com menos de 50 anos de idade, com base em revisões recentes, devem considerar o início da prevenção do câncer colorretal 5 anos antes do recomendado para a população em geral, isto é, aos 45 anos. Mas não precisam realizar os exames de prevenção com mais frequência do que a população em geral.
ᴥ»Câncer colorretal – A cirurgia é o tratamento primário para os 80% dos cânceres colorretais que não apresentam metástase. Apesar da cirurgia curativa e do uso de quimioterapia adjuvante moderna e/ou radioterapia (RT), mais de 40% dos pacientes que apresentam doença em estágio II ou III terão recorrência da doença após a terapia primária. Programas intensivos de vigilância pós-operatória são justificados, na esperança de que a detecção precoce de recorrências assintomáticas, aumente a proporção de pacientes potencialmente elegíveis para uma segunda terapia curativa.
VEJA DETALHES AQUI! ➡
História pessoal de pólipos neoplásicos (adenoma ou serrilhado)
Aumenta o risco de câncer colorretal no futuro. O número e os tipos dos pólipos orientam o intervalo apropriado para a vigilância. Se houver incerteza sobre a história pessoal do pólipo e os registros não puderem ser obtidos, deve-se considerar que pólipo era neoplásico. O risco relativo varia de aproximadamente 3,5 a 6,5 em tais pacientes.
VEJA DETALHES AQUI! ➡
Doença inflamatória intestinal
A retocolite ulcerativa e a doença de Crohn são doenças inflamatórias benignas que causam inflamação em graus variados na mucosa do intestino grosso. A doença inflamatória intestinal está associada ao maior risco de câncer colorretal, especialmente as com mais de 8 anos de tratamento que comprometem amis de 1/3 do intestino.
VEJA DETALHES AQUI! ➡
Radioterapia
Uma história de radioterapia para câncer de próstata está associada a um risco aumentado de câncer retal. A magnitude do risco é aproximadamente semelhante à observada em pacientes com história familiar de adenomas do cólon.
É importante ressaltar que os pacientes que possuam um ou mais fatores de risco não necessariamente desenvolverão câncer.
A doença tem uma fisiopatologia complexa que depende tanto de fatores genéticos quanto de causas ambientais. Cabe citar também que o câncer colorretal quando detectado precocemente tem altas chances de cura.
Fatores protetores para o câncer colorretal
Um grande número de fatores protetores é descrito em estudos como associados a um risco menor de câncer colorretal.
Atividade física
Dados sugerem que a atividade física regular, seja ocupacional ou de lazer, está associada à proteção do câncer colorretal. Redução significativa de até 25% no risco de câncer colorretal quando comparado com os indivíduos menos ativos. O mecanismo subjacente à aparente associação protetora de atividade física não é conhecido.
Dieta
Frutas e vegetais – Muitos estudos epidemiológicos mostraram a ação protetora da dieta rica em frutas e vegetais. Dados sugerem que pode haver pouco benefício em aumentar o consumo de frutas e vegetais além dos níveis associados à ingestão de uma dieta razoavelmente equilibrada. Em comparação com os não-vegetarianos, os padrões alimentares vegetarianos também são associados a um risco significativamente reduzido de câncer colorretal.
Fibra – Vários estudos laboratoriais, nutricionais e epidemiológicos identificaram um papel para a fibra alimentar no desenvolvimento do câncer colorretal. No entanto, o grau em que a fibra dietética protege contra o desenvolvimento do adenoma/serrilhado ou câncer colo é incerto. O tipo de fibra pode ser um fator importante, como a ingestão de fibra de cereais não processada (insolúveis), que pode ser mais eficaz nos benefícios em comparação com formas mais processadas. Em última análise, o grau de proteção da fibra dietética, se houver, provavelmente permanecerá instável na ausência de estudos prospectivos de intervenção.
Ácido fólico – Não está claro se o ácido fólico tem papel na prevenção do câncer colorretal. Por outro lado, a possibilidade de que a suplementação de ácido fólico aumenta o risco de câncer de cólon também foi levantada. Dados observacionais sugerem que a suplementação com ácido fólico pode ser benéfica no estágio pré-adenoma, mas não além disso.
Vitamina B6 (piridoxina) – Os dados disponíveis sugerem uma associação modesta entre maior consumo de vitamina B6 (piridoxina) e menor risco de câncer colorretal.
Cálcio e produtos lácteos – Outro possível fator de proteção é o aumento da ingestão de cálcio suplementar ou dietético. Pelo menos três estudos controlados confirmaram a eficácia da suplementação de cálcio na prevenção da recorrência de adenomas colorretais. Mas não está comprovada que a suplementação de cálcio reduza o risco do câncer colorretal. O efeito protetor do cálcio para adenomas convencionais depende da constituição genética de cada pessoa. A suplementação de cálcio tem sido recomendada para a prevenção primária ou secundária de adenomas do cólon pela American College of Gastroenterology.
Estudos do efeito do uso dos produtos lácteos na prevenção do câncer colorretal são controversos. Acredita-se que produtos lácteos protejam contra o câncer colorretal devido ao seu alto teor de cálcio; no entanto, alguns produtos lácteos, como queijo e creme, têm alto teor de gordura, o que pode contrabalançar o efeito protetor, possivelmente afetando a composição do ácido biliar no cólon. A maior ingestão de leite e produtos lácteos totais foram associadas a uma redução significativa, mas modesta do risco de câncer colorretal.
Vitamina D – A vitamina D e seus metabólitos atuam como inibidores da progressão do câncer colorretal. Estudos de longo prazo revelaram uma ligação entre o baixo nível de vitamina D e o risco de muitos tipos de câncer, incluindo e principalmente o câncer colorretal. Não se sabe se o risco elevado de câncer colorretal, observado nos pacientes com deficiência de vitamina D, pode ser superado com a sua suplementação. Alguns dados sugerem uma associação entre o baixo nível de vitamina D e a mortalidade em pacientes com câncer colorretal, tanto no cenário de doença metastática avançada quanto na doença potencialmente curável ressecada.
Alho – O consumo de alho tem sido associado a um risco reduzido de adenomas do cólon em alguns estudos observacionais de pacientes com câncer colorretal. O alho foi incluído como um provável fator de proteção pelo Fundo Mundial para Pesquisa do Câncer/Instituto Americano de Pesquisa do Câncer.
Consumo de peixe – O consumo de ácidos graxos ômega 3 (principalmente o óleo de peixe) tem sido associado a uma redução da frequência do câncer colorretal em estudos observacionais. Mas, a associação parece ser modesta e ensaios de intervenção ainda não foram relatados.
Consumo de café – Estudos observacionais encontraram evidências conflitantes sobre a relação entre o consumo de café e o risco de câncer colorretal.
Aspirina e AINEs (antiinflamatórias não esteroides)
Estudos demonstraram efeitos preventivos modestos a moderados em populações de risco médio e alto para o câncer colorretal. O uso regular de aspirina e outros AINEs está associado a uma redução de 20% a 40% no risco de adenomas e câncer colorretal em indivíduos com risco médio. Existem relatos de reduções de 50% na frequência do câncer colorretal após cinco anos de uso.
Várias questões-chave permanecem:
ᴥ» Como a aspirina ou AINEs podem proteger contra o câncer colorretal não é bem compreendida.
ᴥ» A dose mínima e a duração para atingir o efeito protetor ainda são incertas na síndrome de Lynch.
ᴥ» Finalmente, se os AINEs são benéficos para a prevenção em todos os subgrupos de pacientes, não está claro. A acumulação de dados, tanto no contexto da prevenção primária como da prevenção secundária após o diagnóstico de câncer colorretal, sugere que o benefício dos AINEs pode estar limitado a determinados grupos clínicos ou subtipos moleculares de câncer colorretal.
No entanto, a Força-Tarefa de Serviços Preventivos dos Estados Unidos recomendou a aspirina a todos aqueles com pelo menos 10% de risco de eventos cardiovasculares, alavancando também os efeitos preventivos do câncer colorretal. As diretrizes nacionais australianas de 2017 levaram isso um passo adiante, recomendando que todos os australianos entre 50 e 70 anos tomem 100 mg de aspirina com revestimento entérico, desde que não haja contraindicação ao seu uso, como úlcera péptica ativa ou indigestão, hipertensão não controlada, comprometimento renal significativo ou alergia à aspirina.
Terapia hormonal em mulheres
A terapia hormonal pós-menopausa (estrogênio combinado com progesterona e estrogênio isolado) tem sido associada a um risco reduzido de câncer colorretal, embora os dados sejam mais consistentes para o uso combinado. Um achado importante foi que, embora as mulheres que receberam estrogênio combinado com progesterona tivessem uma menor taxa de diagnóstico de câncer colorretal do que o grupo controle, os tumores que ocorreram nesse grupo foram encontrados em um estágio mais avançado do que aqueles encontrados no grupo controle. Esses dados sugerem a possibilidade intrigante de que a terapia hormonal possa diminuir a incidência de terapia hormonal, mas não a mortalidade. Tal paradoxo poderia ser explicado por um atraso sistemático no diagnóstico em mulheres que recebem terapia hormonal combinada de estrogênio e progesterona pós-menopausa, ou poderia sugerir que a terapia hormonal realmente afeta a biologia do câncer colorretal.
Mesmo antes dos dados mais recentes citados acima, a terapia hormonal pós-menopausa não foi recomendada para quimio-prevenção do câncer de cólon em mulheres, devido aos riscos de longo prazo associados à terapia. Além desses dados, um efeito protetor dos contraceptivos orais em mulheres na pré-menopausa foi mostrado em alguns estudos.
Estatinas
Alguns dados observacionais sugerem que as estatinas estão associadas a um efeito protetor contra vários tipos de câncer, incluindo o câncer colorretal, mas, no geral, os dados são conflitantes. Uma redução modesta na incidência de câncer de cólon, como um ponto final secundário, foi observada em dois grandes estudos clínicos avaliando o benefício para doença arterial coronariana.
Antioxidantes
Vários ensaios intervencionais avaliaram a eficácia dos antioxidantes na prevenção de adenomas colorretais. Ensaios clínicos controlados não encontraram evidências convincentes de que os suplementos antioxidantes tivessem um efeito benéfico significativo na prevenção primária ou secundária de adenomas colorretais.
Programas de rastreamento do Câncer Colorretal – Prevenção
São políticas e planos de ação que cubram o programa de prevenção primária (prevenção da ocorrência), quanto secundária (diagnóstico precoce) e terciária (prevenção de deformidades, recidivas e morte). Portanto, ser submetido ao rastreamento do câncer colorretal é quando se é examinado quando está tudo bem, isto é, sem sinais e/ou sintomas.
O rastreamento regular do câncer colorretal é extremamente importante na prevenção da doença. A partir do momento que as primeiras células anormais começam a formar pólipos, até se tornar um câncer colorretal normalmente leva de 10-15 anos.
O rastreamento regular pode, em muitos casos, prevenir completamente o câncer colorretal, porque a maioria dos pólipos encontrados são removidos antes que tenham a chance de se transformar em câncer. O rastreamento também pode diagnosticar o câncer colorretal em estágio inicial (estágio I), quando é altamente curável (cerca de 95%).
Por fim, o rastreamento se resume ao conjunto de medidas tomadas para a identificação e retirada dos pólipos neoplásicos e da detecção do câncer precoce em indivíduos sem sinais e/ou sintomas.
 O programa Bem-Estar da Rede Globo de Televisão mostrou os riscos, o diagnóstico precoce e a prevenção do Câncer Colorretal. VEJA O PROGRAMA AQUI ➡
O programa Bem-Estar da Rede Globo de Televisão mostrou os riscos, o diagnóstico precoce e a prevenção do Câncer Colorretal. VEJA O PROGRAMA AQUI ➡
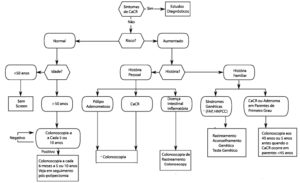 VEJA MAIS SOBRE A PREVENÇÃO DO CÂNCER COLORRETAL AQUI! ➡
VEJA MAIS SOBRE A PREVENÇÃO DO CÂNCER COLORRETAL AQUI! ➡
ALGORITMO PARA A PREVENÇÃO CÂNCER COLORRETAL
Apresentação clínica do câncer colorretal (sinais e sintomas do câncer colorretal)
Pacientes com câncer colorretal podem apresentar-se de três maneiras:
ᴥ» Sintomas e/ou sinais suspeitos;
ᴥ» Indivíduos assintomáticos descobertos pela triagem de rotina (rastreamento);
» Admissão de emergência com obstrução intestinal, peritonite ou, raramente, sangramento gastrointestinal agudo.
Na fase inicial com câncer colorretal não há sintomas na maioria dos pacientes e esses são diagnosticados como resultado dos exames de prevenção. Embora a crescente aceitação dos exames de prevenção tenha levado ao diagnóstico de mais casos em um estágio assintomático, a maioria dos cânceres colorretais (70 a 90%) é diagnosticada após o início dos sinais e/ou sintomas, normalmente extremamente vagos, e se devem ao crescimento do tumor para o interior do intestino ou nas estruturas adjacentes.
Na prática clínica é muito comum o paciente atribuir erroneamente a hemorroidas a causa do sangramento anal. É importante ficar alerta porque “nem tudo que sangra é hemorroida, pois o câncer colorretal também sangra”.
Entretanto, há uma pequena diferença entre os tipos de sangramento. Na hemorroida o sangue vivo não se encontra misturado às fezes, ao passo que no câncer do intestino o sangue de cor viva vem misturado às fezes.
Para o paciente é difícil estabelecer essa distinção. Por isso, toda pessoa que tem sangramento pelo ânus deve procurar o médico especialista da coloproctologia, para se submeter a uma investigação clínica incluindo o exame proctológico e às vezes a colonoscopia, a fim de diagnosticar corretamente a causa do sangramento. Um simples toque retal pode identificar o câncer de reto, além de possibilitar o exame da próstata nos homens.
Sinais e sintomas de alerta para a câncer colorretal
Inicia-se com a consulta com o especialista, o coloproctologista. Consulta dirigida a procura dos fatores de risco para o câncer colorretal e para a presença de algum dos sinais e/ou sintomas sugestivos do câncer colorretal. Segue-se o importante e simples exame proctológico (veja detalhes) para o exame do ânus, reto e sigmóide distal (cerca de 20 cm distais no intestino grosso):
- Qualquer alteração no hábito intestinal: diarreia e/ou constipação ou fica normal.
- Presença de sangue e/ou secreção nas fezes: vivo (hematoquezia) ou escuro (melena).
- Hemorragia digestiva baixa (sangramento anal sem fezes).
- Sensação de que o intestino não esvaziou após uma evacuação ou esforço ineficaz para evacuação.
- Dor no abdome inferior e/ou na região perianal associado ou não a alteração do hábito intestinal.
- Presença de gases intestinal causando distensão e dor abdominal.
- Mudança na consistência e/ou forma das fePerda de peso (emagrecimento).
- Anemia ferropriva (deficiência de ferro devido à perda de sangue visível ou oculto).
- Fraqueza, palidez na pele e nas mucosas, cansaço, falta de memória, tonturas, dores musculares, sonolência, falta de ar ou respiração muito curta, palpitação e taquicardia, porque o coração é obrigado a bater mais depressa.
- Tenesmo retal, sensação de constante necessidade de defecar, apesar do reto estar vazio.
A- Pacientes com sinais e/ou sintomas de risco para o câncer colorretal em qualquer idade ou que se enquadram nos grupos de risco intermediário ou alto risco para o câncer colorretal o exame proctológico é sempre complementado pela colonoscopia.
B- Pacientes sem sinais e/ou sintomas de risco para o câncer colorretal acima dos 50 anos (45 anos – revisão recente), ou seja, exclusivamente de risco médio. Entram para o programa de prevenção secundária do câncer colorretal, assim como os pacientes de risco médio assintomáticos.
O câncer colorretal quando detectado em estágios iniciais tem grandes chances de cura. É importante sempre estar alerta a esses sinais e/ou sintomas, principalmente se você faz parte de algum grupo de risco. Raramente os sinais e/ou sintomas conduzem a um diagnóstico precoce. Portanto o diagnóstico precoce depende basicamente do rastreamento em pessoas assintomáticas pertencentes aos grupos de riscos descritos acima.
Os sinais e sintomas dependem e se relacionam com a localização do câncer nos segmentos colorretais.
ᴥ» Câncer localizado no cólon direito: onde diâmetro é maior, as paredes finas e distensíveis e as fezes são líquidas, a massa tumoral demora mais tempo para ocupar toda a luz intestinal, retardando o início dos sinais e sintomas. Os principais são anemia e alteração do ritmo intestinal com predomínio da diarreia.
ᴥ» Câncer no cólon esquerdo: onde o diâmetro é menor, as paredes espessas e pouco distensíveis, a massa tumoral ocupa toda a luz mais rápido causando obstrução parcial com sinais e/ou sintomas mais precoces como: alteração do ritmo intestinal com predominância da constipação intestinal, ou seja, prisão de ventre até obstrução total.
ᴥ» Câncer de reto, os principais são o sangramento e tenesmo – vontade frequente de ir ao banheiro mesmo sem fezes. Resumindo, qualquer alteração no ritmo intestinal (constipação ou diarreia), anemia, sangue ou catarro nas fezes e emagrecimento são sinais e sintomas de alerta de que o indivíduo possa estar com câncer colorretal.
Prevalência do câncer colorretal nos segmentos do cólon e no reto
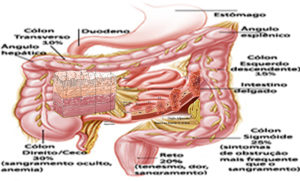 Câncer de cólon ascendente (direito) e ceco – 30%; – Câncer de cólon sigmóide – 25%; – Câncer de reto – 20%; – Câncer no cólon descendente (esquerdo) – 15%; – Câncer no cólon transverso – 10%.
Câncer de cólon ascendente (direito) e ceco – 30%; – Câncer de cólon sigmóide – 25%; – Câncer de reto – 20%; – Câncer no cólon descendente (esquerdo) – 15%; – Câncer no cólon transverso – 10%.
Diagnóstico do Câncer colorretal
O diagnóstico de câncer colorretal é feito pelo exame histológico de uma biópsia geralmente obtida durante a colonoscopia ou de uma amostra cirúrgica. Histopatologicamente, a maioria dos cânceres que surgem no cólon e no reto são adenocarcinomas.
Na suspeita clínica do câncer colorretal, a consulta médica, de preferência com o especialista da coloproctologia, é mandatória e urgente. De acordo com a literatura, o intervalo entre o início dos sinais e sintomas e o tratamento cirúrgico, está entre 7 e 12 meses. Essa perda de tempo se deve a relutância do paciente em procurar atendimento médico porque tende a não dar importância aos sinais e/ou sintomas. Alguns médicos que não estão familiarizados com as doenças colorretais podem não interpretar corretamente os sinais e/ou sintomas.
Uma vez na coloproctologia, a consulta é dirigida para a pesquisa de fatores de risco e dos sinais e/ou sintomas do câncer colorretal. Segue-se o exame físico com atenção aos sinais de anemia e no abdome a pesquisa de massas, e por fim o exame proctológico, onde se examina o canal anal, o reto e os 10 cm distais do cólon sigmóide. EXAME PROCTOLÓGICO ➡
Colonoscopia convencional no diagnóstico do câncer colorretal
A colonoscopia é o teste mais preciso e versátil para o diagnóstico do câncer colorretal, pois pode localizar as lesões colorretais, fazer biópsia, detectar neoplasias simultâneas e ainda remover os pólipos.
Os cânceres colorretais simultâneos (sincrônicos), definidos como dois ou mais tumores primários distintos diagnosticados dentro de seis meses de um câncer colorretal inicial, separados por intestino normal, e não devido à extensão direta ou metástase, ocorrem em 3 a 5% dos pacientes. A incidência é um pouco menor (aproximadamente 2,5%) quando pacientes com síndrome de Lynch (Câncer Colorretal Hereditário Sem Polipose – HNPCC) são excluídos. A presença de cânceres sincrônicos deve levantar a suspeita da síndrome de Lynch ou polipose associada ao MUTYH (doença genética, com transmissão autossômica recessiva, que se associa ao desenvolvimento de múltiplos adenomas e cânceres colorretais).
Quando vistos pela colonoscopia, a grande maioria dos cânceres colorretais são massas friáveis, necróticas, infiltrativas e ulceradas ou polipoides, com sangramento discreto a moderado. Uma minoria dos cânceres (assintomáticas e sintomáticas) são planas ou deprimidas.
A colonoscopia, nas lesões visíveis, faz a biópsia (pequenos fragmentos) e quando possível são completamente removidas (polipectomia, ressecção endoscópica da mucosa ou dissecção endoscópica submucosa).
A tatuagem do local é importante, após a retirada de lesões suspeitas, para a localização subsequente, se uma neoplasia invasiva for encontrada e seja necessária terapia local adicional. A tatuagem também é recomendada próximo a lesões maiores para que possam ser identificadas na cirurgia. As tatuagens são feitas alguns centímetros distais à lesão.
Entre pacientes assintomáticos, as taxas de perda (não são vistas) pela colonoscopia do câncer colorretal, mesmo em mãos de examinadores experientes, variam de 2 a 6%, e os cânceres perdidos estão mais frequentes no cólon direito.
Se o câncer colorretal obstruir o intestino impedindo a colonoscopia completa no pré-operatório, todo o cólon residual deve ser examinado logo após cirurgia. Na ausência de uma obstrução, mas a colonoscopia é incompleta, a opção para examinar o restante do cólon é colonografia por tomografia computadorizada (colonoscopia virtual), veja abaixo.
Os estudos retrospectivos avaliando o período pré-colonoscopia com o pós-colonoscopia, quanto ao grau de invasão tumoral na parede intestinal (classificação de Dukes), ao diagnosticar o câncer colorretal encontraram os seguintes resultados:
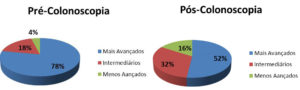 Nos pacientes diagnosticados no período pós-colonoscopia, os mais avançados (Dukes C) diminuíram de 78% para 52% enquanto aumentaram os intermediários (Dukes B) de 18% para 32% e os menos avançados (Dukes A) de 4% para 16%.
Nos pacientes diagnosticados no período pós-colonoscopia, os mais avançados (Dukes C) diminuíram de 78% para 52% enquanto aumentaram os intermediários (Dukes B) de 18% para 32% e os menos avançados (Dukes A) de 4% para 16%.
Colonografia por tomografia computadorizada (colonoscopia virtual)
A técnica utiliza a tomografia computadorizada helicoidal ou ressonância magnética. Emprega sofisticado software de pós-processamento para gerar imagens que permitem ao operador navegar pelo interior do cólon e reto em qualquer direção. Exige uma preparação mecânica do intestino semelhante à da colonoscopia normal, uma vez que as fezes podem simular pólipos.
Colonoscopia convencional incompleta
As taxas de não conclusão da colonoscopia diagnóstica em pacientes sintomáticos são de aproximadamente 12%. Os motivos incluem a incapacidade do colonoscópio de alcançar o tumor ou visualizar a mucosa proximal ao tumor por razões técnicas (câncer parcialmente ou completamente obstruído, cólon tortuoso e preparação ruim) e intolerância do paciente ao exame. Nesse cenário, a colonografia por TC é útil para a detecção do câncer colorretal e pode fornecer um diagnóstico radiográfico, mas não permite fazer biópsia ou retirar pólipos.
A colonografia por tomografia computadorizada (TC) deve ser restrita a pacientes capazes de tolerar a preparação oral. Para pacientes clinicamente obstruídos, uma tomografia computadorizada de protocolo gastrointestinal é uma boa alternativa.
Teste diagnóstico inicial
Estudos de prevenção realizados em pacientes assintomáticos, sugerem que tanto a colonoscopia por tomografia como a colonoscopia convencional têm um rendimento diagnóstico semelhante para detectar o câncer colorretal e os pólipos grandes (> 1 cm). A colonoscopia por TC tem duas grandes desvantagens: caso encontre alterações a colonoscopia convencional é mandatória e a exposição à radiação.
Vantagem da colonoscopia por TC também é a capacidade de detectar lesões extra colônicas, o que pode explicar sintomas e fornecer informações sobre o estágio do tumor, mas também pode gerar ansiedade e custo para investigações desnecessárias e pode ter um baixo rendimento de patologias clinicamente importantes.
Colonoscopia virtual como método de prevenção
Estudos chegaram a relatar sensibilidade de 92% (probabilidade do portador ter o seu teste positivo) com especificidade de 100% (probabilidade do indivíduo normal ter o seu teste negativo) para pólipos adenomatosos medindo 10 mm ou mais. A colonoscopia virtual é um exame que se encontra em aperfeiçoamento tecnológico. Apesar de sua natureza não terapêutica, já se mostrou bastante eficaz na detecção do câncer colorretal, mas quando encontra alterações é sempre necessário realizar a colonoscopia convencional para a biópsia.
http://www.youtube.com/watch?feature=player_embedded&v=WI_TEilpVfc#!
Exames de laboratório
Embora o câncer colorretal esteja frequentemente associado à anemia por deficiência de ferro, sua ausência não exclui de forma confiável a doença. Não há papel diagnóstico para outros exames laboratoriais de rotina, incluindo testes de função hepática, que não têm sensibilidade para a detecção de metástases hepáticas.
Marcadores tumorais – antígeno carcinoembrionário (CEA)
Valores de referência
- Homens adultos: Não fumante: até 3,4 ng/mL / Fumantes: até 6,2 ng/mL
- Mulheres adultas:Não fumante: até 2,5 ng/mL / Fumantes: até 4,9 ng/mL
Vários marcadores séricos foram associados ao câncer colorretal, principalmente o antígeno carcinoembrionário (CEA). No entanto, todos esses marcadores, incluindo CEA, têm uma baixa capacidade de diagnosticar o câncer colorretal primário devido à sobreposição significativa com doença benigna e baixa sensibilidade para doença em estágio inicial. A sensibilidade (probabilidade do portador ter o seu teste positivo) do CEA para o diagnóstico do câncer colorretal é de apenas 46%. Nenhum outro marcador tumoral convencional apresentou uma sensibilidade diagnóstica maior, incluindo o antígeno CA 19-9.
Além disso, a especificidade (probabilidade do indivíduo normal ter o seu teste negativo) do CEA também é limitada. A especificidade do CEA para o diagnóstico de câncer colorretal foi de 89%. As causas não relacionadas ao câncer de um CEA elevado incluem: gastrite, úlcera péptica, diverticulite, doença hepática, doença pulmonar obstrutiva crônica, diabetes e qualquer estado inflamatório agudo ou crônico. Além disso, os níveis de CEA são significativamente mais altos em fumantes do que em não fumantes.
Um painel de especialistas em marcadores tumorais no câncer colorretal recomendou que nem o CEA sérico nem qualquer outro marcador, incluindo o CA 19-9, sejam usados como triagem ou teste de diagnóstico para câncer colorretal.
Quando usado para diagnóstico de câncer colorretal na população geral, para cada caso de câncer colorretal diagnosticado com o CEA e confirmado com biópsia, temos 250 falso-positivos. Resultados negativos podem ocorrer na fase precoce do câncer e em alguns pacientes com câncer colorretal metastático. Geralmente, níveis séricos menores que 10 ng/ml são encontrados em doenças não malignas como:
••Doenças hepáticas: alcoolismo, hepatite crônica ativa, doença biliar primária;
•• Doenças do trato digestivo: úlcera péptica, pancreatite, diverticulite, doença inflamatória intestinal;
•• Doenças pulmonares: bronquite e enfisema;
•• Outras doenças: insuficiência renal, tabagismo.
•• Outros cânceres: pâncreas, estômago, pulmão ou mama.
•• Cirurgia, quimioterapia e radioterapia podem causar aumentos transitórios do CEA.
No entanto, os níveis de CEA têm valor no acompanhamento de pacientes com câncer colorretal diagnosticada. As diretrizes recomendam que os níveis séricos de CEA sejam obtidos no pré-operatório dos pacientes com câncer colorretal, para auxiliar no planejamento do tratamento cirúrgico, no acompanhamento pós-tratamento e na avaliação do prognóstico:
•• O CEA está aumentado em 95% dos pacientes com lesões bem diferenciadas, contra apenas 30% das pessoas com câncer pouco diferenciados.
•• Os níveis séricos de CEA têm utilidade prognóstica em pacientes com câncer colorretal recém diagnosticado. Pacientes com CEA sérico pré-operatório > 5 ng/mL apresentam pior prognóstico, estágio por estágio, do que aqueles com níveis mais baixos, embora pelo menos alguns dados sugiram que um CEA pré-operatório elevado que normalize após a ressecção não seja um indicador de mau prognóstico. Níveis de CEA no pós-operatório deve ser realizado para pacientes com doença nos estágios II e III a cada 3 meses nos primeiros 2 anos de depois a cada 6 meses até completar os 5 anos.
•• Níveis elevados de CEA no pré-operatório que não normalizam após a ressecção cirúrgica implicam a presença de doença persistente e a necessidade de avaliação adicional.
•• Um aumento do nível de CEA após a ressecção cirúrgica implica doença recorrente e deve solicitar imagens radiológicas de acompanhamento. Aumentos maiores que 12,6% ao mês, em amostras seriadas, correlacionam-se com maior probabilidade de recorrência de neoplasias colorretais.
•• O aumento do CEA pode ser observado de 2 a 18 meses antes da detecção clínica da recidiva, isto é, pode preceder evidências de metástases em exames de imagem. Os níveis séricos de CEA têm também mostrado correlação com resposta tumoral ou progressão em pacientes que se submetem a quimioterapia ou radioterapia.
Estadiamento do câncer colorretal
Uma vez que o diagnóstico do câncer colorretal é estabelecido pela biópsia, a extensão local e à distância da doença deve ser determinada para fornecer base para discutir o tratamento e o prognóstico. O estadiamento clínico do pré-tratamento é melhor realizado pelo exame físico (com atenção especial a ascites, hepatomegalia e linfadenopatia), tomografia computadorizada (TC) do abdômen e da pelve e imagens do tórax.
Sistema de estadiamento TNM
O sistema de estadiamento TNM (tumor primário (T), estado dos linfonodos regionais (N) e metástase distante (M) é o sistema de estadiamento preferido para a câncer colorretal. O uso da classificação de Duke é desencorajado. Esses três componentes combinados formam agrupamentos de estágios de I a IV. Os agrupamentos de estágios permitem estratificar o prognóstico, na qual é a base para selecionar o tratamento. As categorias T, N e M para o câncer de cólon são atribuídas com base em:
ᴥ» Se há sinais de câncer disseminados no exame físico ou nos exames de imagem radiográfica.
ᴥ» Resultados da ressecção cirúrgica e exame histológico dos tecidos ressecados.
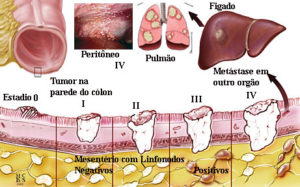
O estágio M1c foi introduzido para refletir a carcinomatose peritoneal como um fator prognóstico ruim, e as micrometástases nodais (aglomerados de tumor > 0,2 mm de diâmetro) agora são pontuadas como positivas, dados os resultados de uma metanálise demonstrando um prognóstico ruim nesses pacientes.
Esta versão também reconhece os seguintes fatores, que são importantes a considerar ao tomar decisões sobre o tratamento, mas ainda não foram incorporados aos critérios de estadiamento formal:
ᴥ» Níveis séricos pré-operatórios de antígeno carcinoembrionário (CEA).
ᴥ» Escore de regressão tumoral, que reflete a resposta patológica à radioterapia pré-operatória, quimiorradioterapia ou quimioterapia e o status da margem de ressecção circunferencial dos cânceres retais.
ᴥ» Invasão linfovascular e perineural.
ᴥ» Instabilidade microssatélites, que reflete a deficiência de enzimas de reparo de incompatibilidade e é um bom fator prognóstico e preditivo de uma falta de resposta à terapia com fluoropirimidina. Ele também identifica pacientes que podem responder aos inibidores do ponto de verificação no cenário de doença metastática avançada. Status de mutação do KRAS, NRASe BRAF, porque mutações nesses genes estão associadas à falta de resposta a agentes direcionados ao receptor do fator de crescimento epidérmico (EGFR).
Achados radiográficos, endoscópicos (incluindo biópsia) e intraoperatórios são usados para atribuir um estágio clínico, enquanto a avaliação do estágio patológico (denominado pT, pN, pM) requer exame anatomopatológico do cólon retirados pela cirurgia. A radiação e a quimioterapia pré-operatórias (como geralmente são realizadas para o câncer retal localmente avançado) podem alterar significativamente o estadiamento clínico; como resultado, o estadiamento patológico pós-terapia é designado com um prefixo yp (ou seja, ypT, ypN).

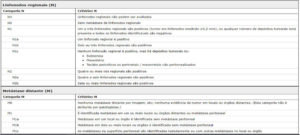
Estadio T Estadio N e M Estadio TNM
Avaliação do estadiamento clínico
O estadiamento clínico pré-operatório é realizado pelo exame físico (com atenção especial a ascites, hepatomegalia e linfadenopatia e potencial fixação de cânceres retais), tomografia computadorizada (TC) do abdômen e pelve e tomografia computadorizada (TC) do tórax. Embora frequentemente obtidas no pré-operatório, as enzimas hepáticas podem ser normais no cenário de pequenas metástases hepáticas e não são um marcador confiável para exclusão do envolvimento hepático. A anormalidade mais comum no teste hepático associada a metástases hepáticas é uma elevação no nível sérico da fosfatase alcalina.
Tomografia computadorizada
A prática padrão é que todos os pacientes com câncer colorretal avançado sejam submetidos a TC de tórax, abdômen e pélvica, antes ou após a cirurgia, uma vez que o resultado ocasionalmente altera o planejamento do tratamento.
Abdômen e pelve
Em pacientes com câncer colorretal recém-diagnosticado, as tomografias de abdome e pelve no pré-operatório podem demonstrar extensão regional do tumor, metástases linfáticas regionais e distantes e complicações relacionadas ao tumor (por exemplo, obstrução, perfuração, formação de fístula). A sensibilidade da TC para detectar metástases à distância é maior (75 a 87 por cento) do que para detectar envolvimento de linfonodos (45 a 73 por cento) ou a profundidade da invasão transmural (aproximadamente 50 por cento). A sensibilidade da tomografia computadorizada para a detecção de linfonodos malignos é maior nos cânceres retais; presume-se que a adenopatia perirretal seja maligna, uma vez que a adenopatia benigna geralmente não é vista nessa área na ausência de processo inflamatório demonstrável (por exemplo, proctite, fístula, abscesso perirretal).
A tomografia computadorizada não é um teste de diagnóstico confiável para identificar implantes peritoneais. A sensibilidade da TC para detectar implantes peritoneais depende da localização e tamanho dos implantes. Em um estudo, a sensibilidade da TC para nódulos <0,5 cm foi de 11% e apenas 37% para implantes de 0,5 a 5 cm.
A descoberta de metástases hepáticas em estudos pré-operatórios pode não necessariamente alterar a abordagem cirúrgica do tumor primário, particularmente em pacientes sintomáticos do tumor primário (por exemplo, sangramento ou obstrução iminente). Em pacientes com quatro ou menos lesões hepáticas, a ressecção pode ser curativa, com taxas de sobrevida livre de recaída em cinco anos de 24 a 38 por cento. Embora a maioria dos cirurgiões defenda a ressecção do tumor primário e metástases hepáticas em duas operações diferentes, alguns abordam os dois locais ao mesmo tempo.
Tórax
O benefício clínico do estadiamento clínico de rotina com a TC do tórax é controverso. Pelo menos em teoria, a imagem do tórax pode ter mais valor para o câncer retal, uma vez que a drenagem venosa do reto inferior ocorre através das veias hemorroidárias até a veia cava, contornando o fígado, e as metástases pulmonares podem ser mais comuns.
O principal problema é o achado frequente de lesões indeterminadas (10 a 30%), que aumentam a complexidade clínica (ou seja, deve ser realizada uma investigação diagnóstica pré-operatória), mas raramente são malignas (7 a 20%). No geral, o risco de malignidade para a maioria dos pacientes com nódulos pulmonares indeterminados (aproximadamente 1 por cento) parece suficientemente baixo para que não seja necessário mais exame diagnóstico pré-operatório.
Ressonância magnética do fígado
A ressonância magnética com contraste (IRM) do fígado pode identificar mais lesões hepáticas do que as visualizadas pela tomografia computadorizada e é particularmente valiosa em pacientes com alterações hepáticas gordurosas. É o estudo de imagem de primeira linha preferido para avaliar as metástases hepáticas do câncer colorretal em pacientes que não foram submetidos a terapia anteriormente.
No entanto, os scanners de TC de nova geração e o uso de imagens trifásicas durante a administração de contraste melhoraram a sensibilidade da TC na detecção de metástases hepáticas. Na prática atual, a ressonância magnética hepática geralmente é reservada para pacientes com achados suspeitos, mas não definitivos, na tomografia computadorizada, principalmente se for necessária uma melhor definição da carga da doença hepática para tomar decisões sobre uma possível ressecção hepática.
Exames de tomografia por emissão de pósitrons (PET-scan)
Não parecem adicionar informações significativas às tomografias para o estadiamento pré-operatório de rotina do câncer colorretal. O papel estabelecido da PET-scan em pacientes com câncer colorretal como um complemento para outras modalidades de imagem é descrito nas seguintes configurações:
ᴥ» Localização do(s) local(ais) de recorrência da doença em pacientes que apresentam um nível CEA sérico elevado e avaliação de imagem convencional não diagnóstica após tratamento primário. Nesse cenário, a PET pode potencialmente localizar a doença oculta, permitindo a seleção de pacientes que podem se beneficiar da cirurgia.
ᴥ» Avaliação de pacientes que se pensa estarem presentes ou futuros candidatos à ressecção de metástases hepáticas câncer colorretal isoladas. O uso rotineiro do PET antes da tentativa de ressecção reduz o número de laparotomias não terapêuticas.
Um ponto importante é que a quimioterapia recente pode alterar a sensibilidade do PET para a detecção de metástases hepáticas colorretais, efeito considerado relacionado à diminuição da atividade metabólica celular do tumor. No entanto, geralmente, o benefício de uma PET scan é detectar metástases extra-hepáticas em pacientes considerados candidatos à ressecção hepática e, nessa situação, é apropriado obter um PET antes do início da quimioterapia.
Estadiamento locorregional para câncer retal
É necessária uma determinação precisa da localização do tumor na extensão do reto e da doença antes do tratamento, a fim de selecionar a abordagem cirúrgica e identificar os pacientes candidatos à quimiorradioterapia inicial antes da cirurgia.
O exame retal digital (DRE), retossigmoidoscopia rígida, ultrassonografia transretal, ultrassonografia endoscópica transretal e ressonância magnética pélvica podem auxiliar na determinação da necessidade de ressecção radical versus excisão local, e se o paciente é candidato à terapia pré-operatória.



Estádio T Estádio N e M Estádio TNM
Câncer Colorretal Intramucoso ou In Situ (Tis) associado ou não ao pólipo
 Quando o câncer colorretal está restrito na camada mais superficial (mucosa), não ultrapassando a muscular da mucosa. Nessa camada não existem linfáticos e, portanto o risco de metástase não existe. O diagnóstico é quase que exclusivamente realizado em exame de laboratório do pólipo retirado com a colonoscopia em pacientes sem sintomas sugestivos de câncer colorretal ou em pacientes pertencentes aos grupos de risco.
Quando o câncer colorretal está restrito na camada mais superficial (mucosa), não ultrapassando a muscular da mucosa. Nessa camada não existem linfáticos e, portanto o risco de metástase não existe. O diagnóstico é quase que exclusivamente realizado em exame de laboratório do pólipo retirado com a colonoscopia em pacientes sem sintomas sugestivos de câncer colorretal ou em pacientes pertencentes aos grupos de risco.
Não necessita de tratamento complementar. Sobrevida em 5 anos é de 100%. Seguimento pela colonoscopia padrão após tratamento do câncer colorretal curativo.
Câncer Colorretal Invasivo associado ou não ao pólipo
Invade além da lâmina própria e ultrapassam o plano da muscular da mucosa invadindo a camada submucosa.
Câncer Colorretal Invasivo Precoce (T1) associado ou não ao pólipo
 É o câncer invasivo restrito à submucosa, não importando a presença de metástase em linfonodos. Nesta camada existem vasos linfáticos e o risco de metástase em linfonodos varia de 5% a 10%. Sobrevida em cinco anos de aproximadamente 85% a 90%.
É o câncer invasivo restrito à submucosa, não importando a presença de metástase em linfonodos. Nesta camada existem vasos linfáticos e o risco de metástase em linfonodos varia de 5% a 10%. Sobrevida em cinco anos de aproximadamente 85% a 90%.
O diagnóstico é quase que exclusivamente realizado em exame de laboratório do pólipo retirado com a colonoscopia em pacientes sem sintomas sugestivos de câncer colorretal ou em pacientes pertencentes aos grupos de risco.
Pólipo com câncer invasivo precoce
Invade além da lâmina própria e ultrapassam o plano da muscular da mucosa.
A retirada endoscópica pode ser curativa e depende da análise de cada caso. O receio se deve ao risco da metástase quando a lesão atinge a submucosa.
Geralmente o pólipo maligno é retirado pela colonoscopia e o exame histológico (anatomopatológico) evidencia o foco de câncer e define os riscos na qual a conduta médica é determinada.
Classificação proposta por Haggitt (Haggitt, 1985) para o câncer colorretal precoce. Um pólipo é considerado pediculado quando o comprimento da haste é maior do que o seu diâmetro (Wilcox e Beck, 1987).
Nessa classificação, definem-se 4 níveis de invasão se o pólipo for pediculado e todos os pólipos sésseis que abrigam carcinoma invasivo são classificados como nível 4 de invasão.
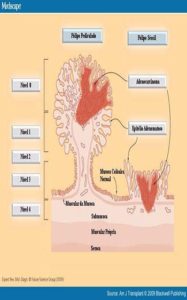 ᴥ» Nível 0 corresponde ao carcinoma in situ;
ᴥ» Nível 0 corresponde ao carcinoma in situ;
ᴥ» Nível 1 corresponde a invasão da muscular da mucosa limitada à cabeça do pólipo;
ᴥ» Nível 2 corresponde à invasão do colo do pólipo (o colo é definido como a região do pedículo onde se dá a transição entre o componente adenomatoso e o revestimento epitelial normal);
ᴥ» Nível 3 corresponde à invasão da haste ou pedículo;
ᴥ» Nível 4 corresponde à invasão da submucosa da parede intestinal na base do pólipo.
As lesões sésseis com câncer invasivo restrito à submucosa (T1) e nível 4 de Haggitt são subdividido em:
ᴥ» sm1 – invasão do terço mais superficial da submucosa, atingindo somente a camada muscular da mucosa;
ᴥ» sm2 – invasão do terço médio;
ᴥ» sm3 – invasão superficial da muscular própria. A principal dificuldade dessa classificação é a significativa variabilidade intra e inter-observador associada à determinação do nível de invasão dentro de uma camada fina como a submucosa intestinal.
As lesões pediculadas, os níveis de invasão Haggitt 1, 2 e 3 correspondem a sm1 e o nível 4 se subdivide em sm1, sm2 ou sm3 conforme descrito acima.
Após a ressecção endoscópica com o anatomopatológico descrevendo o pólipo como maligno, cria uma pergunta a responder. O paciente está curado?
ᴥ» Câncer intramucoso (“in situ”) é considerado curado desde que a polipectomia ou mucosectomia seja adequada;
ᴥ» Câncer invasivo em qualquer situação não é considerado curado e a cirurgia clássica (colectomia segmentar) está indicada na maioria porque o risco de comprometimento linfonodal chega a 9%.
O risco de comprometimento linfonodal aumenta de acordo com a presença dos seguintes parâmetros anatomopatológicos: ᴥ» Carcinoma indiferenciado ou pouco diferenciado;
ᴥ» Embolização linfática;
ᴥ» Embolização venosa;
ᴥ» Nível 4 de Haggitt;
ᴥ» Nível de invasão Sm3;
ᴥ» Margem de ressecção: menor do que 2 mm.
Os pólipos malignos são classificados de acordo com seu prognóstico em dois tipos:
ᴥ» Bom prognóstico: células bem diferenciadas, margens livres de tumor > 2 mm e ausência de invasão intravascular e linfática. Nestes casos a recidiva tumoral gira em torno de 1,5%. Nos pacientes com alto risco cirúrgico (estado geral, idade avançada, e/ou doenças associadas) o procedimento endoscópico poderá ser considerado suficiente. Neste caso é importante tatuar com nanquim as proximidades e não o local da lesão, para não dificultar a identificação de possível recidiva. Colonoscopia de seguimento varia de 1 a 3 anos.
ᴥ» Mau prognóstico: células indiferenciadas ou pouco diferenciadas, margem de ressecção menor que 2 mm e invasão intravascular e linfática. Nestes casos o risco de tumor residual é alto, em torno de 9%. A colectomia segmentar oncológica está indicada. Neste caso é importante tatuar com nanquim as proximidades para que o cirurgião laparoscópico identifique com precisão o segmento a ser ressecado.
Câncer Colorretal Invasivo Avançado (T2 ou T3 ou T4)
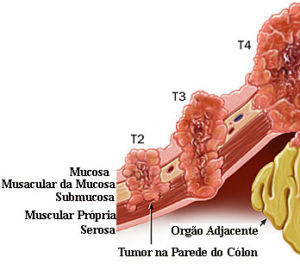 É o Câncer Colorretal Invasivo que compromete a camada muscular própria, não importando a presença de metástase em linfonodos.
É o Câncer Colorretal Invasivo que compromete a camada muscular própria, não importando a presença de metástase em linfonodos.
T2: Tumor invade a muscular própria;
T3: Tumor invade a subserosa, ou além (sem envolver outros órgãos);
T4: Tumor perfura a serosa invadindo ou não órgãos adjacentes.
O câncer colorretal avançado no cólon esquerdo, na medida em que cresce, tende a se tornar anular correspondendo aos achados radiológicos (enema opaco) do tipo “maçã mordida” ou “anel de guardanapo”. No cólon esquerdo, as lesões são, habitualmente, mais infiltrativas, o seu volume projetado a partir da superfície mucosa é menor e logo tendem a assumir o padrão anular e causa obstrução.
No cólon direito o câncer colorretal cresce geralmente formando massa polipóide volumosa, que se estende ao longo da superfície alargada do ceco ou ascendente e, em oposição aos cânceres do lado esquerdo, tendem a permanecer superficiais por mais tempo. A obstrução é, dessa forma, incomum devido ao maior diâmetro do cólon direito.
Na colonoscopia a identificação é bem característica pela presença de lesão multinodular, de superfície irregular, cruenta e friável, de limites pouco precisos, e com aspecto invasivo causando rigidez da parede e impedindo ou dificultando a passagem do colonoscópio quando muito avançado.
Classificação Macroscópica de Borrmann do câncer colorretal invasivo
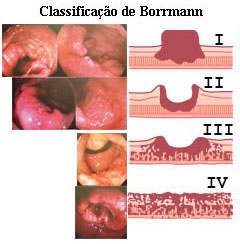
Borrmann I – Lesão polipóide ou vegetante, bem delimitada.
Borrmann II – Lesão ulcerada, bem delimitada, de bordas elevadas.
Borrmann III – Lesão ulcerada, infiltrativa em parte ou em todas as suas bordas.
Borrmann IV – Lesão difusamente infiltrativa, não se notando limite entre o tumor e a mucosa normal.
Classificação Microscópica
Histologicamente o câncer colorretal pode ser bem diferenciado (20%), moderadamente diferenciado (60%) e indiferenciado ou pouco diferenciado (20%) sendo importante para o prognóstico. A incidência de metástase pra linfonodos é de 25%, 50% e 80% respectivamente. A sobrevida em 5 anos é de 77%, 61% e 29% respectivamente.
| Histologicamente | bem diferenciado (20%) | moderadamente diferenciado (60%) | indiferenciado ou pouco diferenciado (20%) |
| Metástase pra linfonodos | 25% | 50% | 80% |
| Sobrevida em 5 anos | 77%, | 61% | 29% |
Tumores coloides ou mucinosos
Produzem grande quantidade de mucina que deslocam o núcleo celular para a periferia da célula criando o aspecto de anel de sinete. Estes tumores, embora possuam graus diferentes de diferenciação, são mais frequentes no cólon direito, em pacientes jovens e são mais agressivos localmente e metastizam-se mais precocemente e em maior frequência por via hematogênica que os demais.
Geralmente diagnosticados em estágio mais avançado e, portando de pior prognóstico. Consequentemente as taxas de ressecções são reduzidas de 90% para 73%, a taxa de ressecção curativa de 69% para 42% e a sobrevida média em 5 anos de 37% para 18%. Pelo maior risco de recorrência local autores sugerem ressecções mais alargadas retirando o maior número possível de linfonodos.
Lesões tipo IV de Borrmann (linite plástica)
São raras no cólon e reto, são geralmente do tipo histológico pouco diferenciado ou mucinoso, portanto são mais agressivos quanto à invasão local e a metástase à distância.
Fatores prognósticos do câncer colorretal
O câncer colorretal é uma doença comum e letal. Anualmente, aproximadamente 51.020 americanos morrem de câncer colorretal, representando aproximadamente 8% de todas as mortes por câncer.
A cirurgia é a principal modalidade de tratamento para o câncer colorretal em estágio inicial (estágio I a III). A ferramenta mais poderosa para avaliar o prognóstico após cirurgias potencialmente curativas é a análise patológica (biópsia) do intestino retirado, embora outras características clínicas, moleculares e histológicas podem influenciar o prognóstico independentemente do estágio. Entre os pacientes com doença em estágio IV, o prognóstico está mais intimamente ligado à localização e extensão da doença metastática distante.
Idade
Pessoas com câncer colorretal com menos de 40 anos (2% a 6%); maiores de 75 anos (40%). Não se sabe o porquê, mas os jovens são mais afetados por tumores mais agressivos (indiferenciados e mucinosos) de crescimento mais rápido e metastização mais precoce. Mas a sobrevida em 5 anos é a mesma em qualquer idade quando se considera os pacientes portadores de câncer colorretal no mesmo estágio e tipo histológico submetidos ao mesmo tipo de tratamento. Complicações cirúrgicas a longo prazo, toxicidades tardias da quimioterapia e radioterapia (TR) e comorbidades com o avançar da idade podem estar associadas a menor qualidade e vida entre os sobreviventes de CRC ≥5 anos após o diagnóstico.
Aparência grosseira – Macroscópica
Embora todos os cânceres colorretais sejam originários de adenomas ou displasia plana, eles evoluem para diferentes padrões morfológicos de invasão e expansão. Os tumores no cólon proximal ou direito geralmente aparecem como massas exofíticos – polipoides e vegetantes. O sangramento oculto pode resultar na apresentação clínica de uma anemia inexplicável por deficiência de ferro.
Por outro lado, os tumores que envolvem o cólon distal ou esquerdo são lesões anulares ou circundantes que produzem uma aparência de “miolo de maçã” ou “anel de guardanapo”. A luz intestinal fica estreitado, produzindo sintomas de disfunção intestinal (por exemplo, constipação, diarreia ou obstrução intestinal). A presença de obstrução intestinal clínica ou perfuração da parede intestinal piora o prognóstico geral.
Apesar das diferenças em sua aparência grosseira, os cânceres de cólon do lado direito e esquerdo são microscopicamente semelhantes e parecem ter um prognóstico semelhante quando se apresentam com doença locorregional. No entanto, no cenário de doença metastática, pelo menos alguns dados sugerem um pior prognóstico para aqueles com tumor primário do lado direito.
O câncer de cólon síncrono (simultâneo), definido como dois ou mais tumores primários distintos, separados pelo intestino normal e não devido à extensão direta ou metástase, ocorre em 3 a 5% dos pacientes. Têm o mesmo prognóstico que um câncer solitário quando o estágio mais alto da doença na apresentação é comparado.
Histologia – Microscópica
A grande maioria dos tumores do cólon e do reto são carcinomas e destes 90% são adenocarcinomas. A classificação da Organização Mundial da Saúde (OMS):
ᴥ» Adenocarcinoma serrilhado;
ᴥ» Adenocarcinoma do tipo adenoma;
ᴥ» Adenocarcinoma micropapilar;
ᴥ» Adenocarcinoma mucinoso;
ᴥ» Carcinoma pouco coeso;
ᴥ» Carcinoma de células de anel de sinete;
ᴥ» Adenocarcinoma medular;
ᴥ» Carcinoma adenoescamoso;
ᴥ» Carcinoma indiferenciado, SOE;
ᴥ» Carcinoma com componente sarcomatoide.
Algumas dessas variantes morfológicas têm significado prognóstico. Como exemplo, os carcinomas de células do anel de sinete são um subtipo de adenocarcinoma agressivo com um prognóstico ruim, enquanto o subtipo de adenocarcinoma medular tem um prognóstico relativamente favorável.
O grau histológico de diferenciação leva em consideração o grau em que existem glândulas bem formadas:
ᴥ» Grau 1– Bem diferenciado (> 95% de formação de glândulas);
ᴥ» Grau 2– Moderadamente diferenciado (formação de glândulas de 50 a 95%);
ᴥ» Grau 3– Pouco diferenciado (<50% de formação de glândulas);
ᴥ» Grau 4– Indiferenciado (sem formação de glândulas ou mucinas (sem diferenciação escamosa ou neuroendócrina).
Recomenda o uso de um sistema de duas divisões, juntando o bem e moderadamente diferenciado em baixo grau e pouco diferenciado e indiferenciado em alto grau. Isso simplifica a classificação, mas preserva o poder prognóstico.
Os tumores que produzem grandes quantidades de mucina extracelular (isto é, mucina compreendendo ≥50 por cento da massa tumoral) são classificados como carcinomas mucinosos. Esse tipo histológico é responsável por aproximadamente 11 a 17% de todos os cânceres colorretais. Os carcinomas mucinosos têm uma predileção pelo lado direito do cólon e podem ter uma resposta fraca à quimiorradioterapia inicial (neoadjuvante) e quimioterapia adjuvante.
O carcinoma de células em anel de sinete é responsável por apenas 1 a 2 por cento de todos os cânceres colorretais, mas é uma variante agressiva com propensão a uma ampla propagação intramural e carcinomatose peritoneal.
Alguns tipos de câncer, particularmente aqueles que surgem no cólon distal, contêm áreas de diferenciação escamosa e são denominados carcinomas adenoescamosos. Esses tumores raros representam entre 0,05 e 0,2% de todas as neoplasias colorretais e estão associados a uma maior mortalidade geral e específica ao colorretal, em comparação com o adenocarcinoma.
Aproximadamente 10% dos cânceres colorretais, particularmente tumores pouco diferenciados, contêm focos de diferenciação neuroendócrina. Os tumores que não formam glândulas com predomínio de diferenciação neuroendócrina são classificados como tumores neuroendócrinos (carcinóides) bem diferenciados, que têm um prognóstico mais favorável que os adenocarcinomas e carcinomas neuroendócrinos pouco diferenciados, com um prognóstico ruim.
O subtipo de carcinoma medular é um tipo distinto de câncer que não forma glândula. Esses tumores caracteristicamente apresentam um alto grau de instabilidade de microssatélites, frequentemente em combinação com mutação BRAF e estão associados a um bom prognóstico.
Padrões de disseminação
O câncer colorretal pode se espalhar por via linfática e hematogênica, bem como disseminação contígua e transperitoneal. Os locais metastáticos mais comuns são os linfonodos regionais, fígado e pulmões. Como a drenagem venosa do trato intestinal ocorre através do sistema portal, o primeiro local de disseminação hematogênica é geralmente o fígado, seguido por pulmões, ossos e muitos outros locais, incluindo (raramente) o cérebro. No entanto, os tumores que surgem no reto distal podem sofrer metástases inicialmente nos pulmões, porque a veia retal inferior drena para a veia cava inferior e não para o sistema venoso portal.
Estadiamento TNM
O sistema de estadiamento tumoral, linfonodal, metástase (TNM) é o sistema de estadiamento preferido para o câncer colorretal. Os achados radiográficos, endoscópicos (incluindo biópsia) e intra-operatórios são usados.
A revisão mais recente da classificação de estadiamento TNM está descrita abaixo.



Estadio T Estadio N e M Estadio TNM
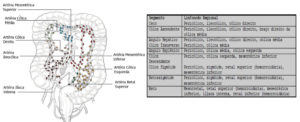
Linfonodos regionais
 Os linfonodos regionais para cada segmento do intestino grosso são designados na figura. O impacto prognóstico do número total de nós ressecados e envolvidos é discutido em detalhes abaixo.
Os linfonodos regionais para cada segmento do intestino grosso são designados na figura. O impacto prognóstico do número total de nós ressecados e envolvidos é discutido em detalhes abaixo.
Câncer in situ
 A categoria pTis inclui invasão estromal de células malignas através da lâmina própria na mas não através da mucosa muscular. Isso é exclusivo do intestino grosso e justifica-se porque a mucosa colorretal, diferentemente da mucosa em outras partes do trato gastrointestinal (GI) e em outros órgãos, carece de linfáticos estromais. Como resultado, os tumores que invadem a mucosa muscular não têm acesso à vasculatura linfática regional e não podem fazer metástases por essa via.
A categoria pTis inclui invasão estromal de células malignas através da lâmina própria na mas não através da mucosa muscular. Isso é exclusivo do intestino grosso e justifica-se porque a mucosa colorretal, diferentemente da mucosa em outras partes do trato gastrointestinal (GI) e em outros órgãos, carece de linfáticos estromais. Como resultado, os tumores que invadem a mucosa muscular não têm acesso à vasculatura linfática regional e não podem fazer metástases por essa via.
Estadiamento pós-terapia para câncer retal
A terapia pré-operatória ou neoadjuvante é cada vez mais empregada para tumores retais. Comparada à cirurgia inicial seguida pela terapia adjuvante, a terapia neoadjuvante está associada a menor toxicidade relacionada ao tratamento a longo prazo e, em alguns casos, preservação da função do esfíncter anal.
Fatores determinantes para o prognóstico
O indicador mais importante do resultado após a ressecção do câncer colorretal é o estágio patológico na apresentação. A sobrevida em cinco anos estratificada pelo estágio do tumor no diagnóstico do câncer de cólon usando os critérios de estadiamento de 2010 é ilustrada na figura.
As seções abaixo resumirão as informações mais recentes sobre determinantes prognósticos para o câncer colorretal, de acordo com a classificação mais recente (2017) de tumor, linfonodo e metástase (TNM).
Características patológicas
Extensão local do tumor
A extensão local da doença (profundidade da penetração do tumor) influencia independentemente a sobrevida. No entanto, as características que determinam a categoria T são variáveis, particularmente a presença ou ausência de envolvimento da serosa.
A determinação histológica da penetração na serosa é difícil e a interpretação conservadora pode levar a subestimação da doença. No entanto, quando há incerteza quanto ao grau de extensão do tumor, a atribuição do menor valor é justificada pelas regras gerais do estadiamento. O significado prognóstico do tumor que se aproxima (<1 mm) da superfície serosa, mas não penetra na serosa não é claro, mas foi sugerido que pressagiaria um risco maior de recaída peritoneal.
O envolvimento peritoneal local ocorre quando:
ᴥ» Reação inflamatória mesotelial e/ou hiperplásica com tumor próximo à superfície serosa;
ᴥ» Tumor presente na superfície serosa com reação inflamatória, hiperplasia mesotelial e/ou erosão ou ulceração;
ᴥ» Células tumorais livres na superfície serosa do peritônio com ulceração subjacente do peritônio visceral.
Todos afetam adversamente o prognóstico. Nos casos em que o envolvimento peritoneal é incerto, a categoria menor (isto é, T3) deve ser designada.
Para partes do colo que não são cobertas pelo peritônio (bordas posteriores do cólon ascendente e descendente, porção inferior do reto), a categoria T4a não é aplicável.
Dados mais recentes sugerem que o tamanho do tumor pode ser um fator prognóstico adverso para o cólon, mas não para o câncer retal. O tamanho total > 4,5 cm foi um preditor independente de mau resultado, mas o ponto de corte ideal para o tamanho indicativo de um prognóstico adverso variou com a localização anatômica no cólon, diminuindo da direita para a esquerda.
Tumor residual
Tumor residual após terapia definitiva é um fator prognóstico adverso. A completude da ressecção depende em grande parte do status da margem de ressecção circunferencial (radial), embora a designação seja global e inclua as margens transversais e outras doenças observadas, mas não removidas na cirurgia.
A designação R indica doença residual local após a conclusão da terapia e é apropriada apenas no cenário da doença M0. Os códigos de doenças residuais no sistema de estadiamento TNM (R0, R1 e R2) são definidos da seguinte maneira:
ᴥ» R0– Ressecção completa do tumor com todas as margens histologicamente não envolvidas;
ᴥ» R1– Ressecção incompleta do tumor com comprometimento da margem da ressecção cirúrgica microscópica (margens grosseiramente não envolvidas);
ᴥ» R2– Ressecção incompleta do tumor com tumor residual bruto que não foi ressecado (tumor primário, linfonodos regionais ou envolvimento da margem macroscópica).
Margem circunferencial (radial)
A margem de ressecção circunferencial corresponde à superfície não peritonealizada e dissecada cirurgicamente da amostra. Este termo se aplica a qualquer aspecto do colo que não é coberto (ou parcialmente coberto, como no cólon ascendente e descendente e no retossigmóide) por uma camada serosa e que deve ser dissecado do retroperitônio. Para os cânceres retais médio e distal que são inteiramente extraperitoneais no local, toda a superfície externa da amostra é considerada margem radial.
Para segmentos do cólon que são completamente envoltos pela serosa, a única margem cirúrgica dissecada cirurgicamente é a margem mesentérica, a menos que o câncer seja aderente ou invasor um órgão ou estrutura adjacente.
Para o câncer retal, a qualidade da técnica cirúrgica e o status da margem radial são os fatores preditivos mais importantes para a recorrência local e distante, bem como a sobrevida. A excisão total mesorretal (EMT) com afastamento cirúrgico adequado ao redor da borda penetrante do tumor diminui a taxa de recidiva local.
Para pacientes que não receberam radioterapia no pré-operatório, a positividade para margem radial representa uma indicação para a radioterapia no pós-operatório, independentemente da extensão local do tumor, principalmente para os cânceres retais.
Linfonodos regionais
O envolvimento regional dos linfonodos é um dos preditores mais fortes de resultado após o tratamento cirúrgico do câncer colorretal, perdendo apenas para a presença de metástases à distância. A disseminação linfonodal é uma indicação da terapia adjuvante tanto para o câncer de cólon quanto para o câncer retal, a fim de reduzir o risco de metástases letais de câncer recorrente em órgãos distantes.
É discutido se as metástases distantes fatais são semeadas por metástases linfonodais ou se os linfonodos regionais agem como uma barreira para capturar células cancerígenas primárias com potencial intrínseco à competência metastática. A disseminação metastática distante geralmente segue a drenagem venosa e não linfática, e pelo menos alguns dados sugerem que metástases linfáticas e distantes surgem de subclones tumorais independentes em um número substancial de casos. Esses achados sustentam a visão de que o envolvimento linfonodal reflete o potencial metastático intrínseco.
A frequência do envolvimento do linfonodo regional está relacionada à profundidade da invasão da parede pelo tumor primário e ao grau histológico. O número de linfonodos envolvidos é um forte preditor de resultados. Como resultado, a classificação TNM estratifica o envolvimento linfonodal de acordo com o número de linfonodos envolvidos. O número de linfonodos envolvidos influencia o resultado nas categorias N1 e N2, independentemente da categoria T, tanto para o câncer retal quanto para o cólon. Além do número de linfonodos envolvidos, o número total de linfonodos na amostra cirúrgica influencia diretamente o prognóstico da doença em estágio II (negativo para linfonodo) e estágio III (positivo para linfonodo).
As diretrizes de grupos de especialistas recomendam que pelo menos 12 linfonodos sejam examinados histologicamente para determinar com precisão o status linfonodal. Se menos de 12 linfonodos estiverem presentes na amostra cirúrgica, técnicas adicionais, como limpeza de gordura, devem ser usadas para tentar aumentar o rendimento nodal.
Micrometástases nodais
Existe controvérsia quanto ao significado prognóstico de células tumorais isoladas (ITCs) ou micrometástases em linfonodos regionais. Na atual classificação de estadiamento TNM de 2010, ITCs e micrometástases não contam como doença linfonodal positiva, embora a presença de ITCs, sejam detectadas por técnicas histológicas padrão ou IHC, sejam codificadas como pN0 (i +) e um tumor detectado apenas por técnicas moleculares especiais.
As micrometástases linfonodais (grupos de tumores > 0,2 mm de diâmetro) são especificamente designados como positivo, enquanto células tumorais isoladas não são pontuadas.
Depósitos tumorais não linfonodais extramurais
São nódulos discretos de tumor de qualquer tamanho na gordura pericólica ou perirretal ou no mesentério adjacente. Eles são considerados o equivalente a metástases linfonodais, mesmo que não possuam arquitetura nodal residual, e são representados como doença N1c na ausência de metástases em qualquer um dos linfonodos regionais identificados. Cada um deve ser contado separadamente e o número deve ser registrado no relatório de patologia.
A presença desses depósitos tumorais é uma forte característica prognóstica adversa. A influência adversa no prognóstico é observada em pacientes com e sem metástases linfonodais. A presença de depósitos extranodais extramurais está fortemente ligada à presença de invasão venosa extramural.
Regressão tumoral após terapia neoadjuvante
Em pacientes adequadamente selecionados com câncer retal, a quimiorradioterapia neoadjuvante está associada a resposta tumoral significativa e diminuição do estadiamento. Para esses pacientes, o prognóstico é melhor determinado pelo estágio patológico pós-tratamento. A erradicação do tumor, conforme detectada pelo exame patológico da amostra ressecada, está associada a um prognóstico significativamente melhor em comparação com pacientes com tumor residual, particularmente doença nodal residual. Da mesma forma, a doença residual mínima está associada a um prognóstico melhor do que a doença residual grave.
Invasão linfovascular
A invasão tumoral em veias ou pequenos vasos não muscularizados que podem representar linfáticos pós-capilares ou vênulas é um importante determinante prognóstico. Tanto a invasão venosa, particularmente de veias extramurais, quanto a invasão linfática representam fatores prognósticos adversos independentes. Dada sua importância prognóstica, é um dos fatores clínico-patológicos incluídos na definição de câncer de cólon em estágio II de “alto risco”.
Invasão perineural
Existem evidências de nível 1 de que a invasão perineural (PNI) está associada a um mau prognóstico. Dada a sua importância prognóstica, o PNI é outro dos fatores clínico-patológicos incluídos na definição de câncer de cólon em estágio II de “alto risco”.
Tipo histológico, grau de diferenciação e presença de mucina
Como regra geral, o tipo histológico não provou ser um fator prognóstico independente para adenocarcinomas colorretais, com exceção de alguns subtipos de alto grau (por exemplo, anel de sinete, pouco diferenciado ou indiferenciados). A classificação histológica é subjetiva, com variabilidade significativa entre os observadores e nenhum sistema uniformemente usado e amplamente aceito.
Borda do tumor
A configuração do tumor na borda de avanço (ou seja, a borda do tumor) tem um significado prognóstico independente do estágio. Especificamente, um padrão de crescimento irregular e infiltrativo, em oposição a uma borda suave (expansível), demonstrou ser um fator prognóstico adverso.
As seguintes características são indicativas de uma borda infiltrativa:
ᴥ» Incapacidade de definir os limites da invasão tumoral e/ou distinguir tecido normal do maligno pelo exame a olho nu de uma lâmina microscópica da borda;
ᴥ» No exame microscópico da borda do tumor, disseminação do tumor por toda a espessura da muscular própria.
A “brotação” do tumor é outra característica específica da borda do tumor que é definida como aglomerados microscópicos de células cancerígenas indiferenciadas. Especialmente quando é extensa, pode ter um valor prognóstico pior.
Localização do tumor
Em muitos estudos, a localização primária do tumor é um fator prognóstico no câncer colorretal. Tumor primário do lado esquerdo (localização do tumor na flexão esplênica ou além dela) está associada a um risco significativamente reduzido de morte, e isso foi independente do estágio e uso de quimioterapia adjuvante.
CEA (antígeno carcinoembriogênico) sérico pré-operatório
Na maioria dos estudos, altos níveis pré-operatório do marcador tumoral CEA têm significado prognóstico, embora o valor de corte ideal seja discutido. Em vários estudos, os níveis de CEA ≥ 5,0 ng/ml têm um impacto adverso na sobrevida independente do estágio do tumor.
Pacientes com câncer linfonodo negativo e um CEA pré-operatório alto podem ser considerados com risco acima da média de recorrência após a cirurgia, isso pode influenciar a decisão de administrar quimioterapia adjuvante, particularmente se outros fatores de risco (por exemplo, obstrução, perfuração), mas não há dados que apoiam diretamente os benefícios da quimioterapia adjuvante nesse cenário específico.
Os níveis pré-operatórios de CEA não são considerados um dos fatores clínico-patológicos que definem o câncer de cólon em estágio II de “alto risco”.
Obstrução intestinal e/ou perfuração
Muitos trabalhos indicam que obstrução e/ou perfuração são preditores independentes de pior prognóstico e sobrevida. Alguns concluíram que os cânceres colorretais que precisam de cirurgia de emergência devido a obstrução ou perfuração geralmente mostram um perfil histopatológico mais agressivo (estágio mais avançado, características histológicas desfavoráveis) do que os casos eletivos.
Tanto a obstrução quanto a perfuração são consideradas fatores clínico-patológicos que definem o câncer de cólon em estágio II de “alto risco” o que pode influenciar o uso da quimioterapia adjuvante nesse cenário.
Fatores moleculares
O valor prognóstico de uma grande variedade de marcadores moleculares promissores e potencialmente clinicamente aplicáveis foi estudado no câncer colorretal. Até o momento, o único fator usado rotineiramente para a tomada de decisão em atendimento clínico é a deficiência de MMR (instabilidade de microsatélites. Outro marcador é usado por sua capacidade preditiva (as mutações RAS preveem a falta de eficácia para agentes direcionados ao EGFR), e um terceiro marcador (mutações BRAF) tem utilidade potencial como fator prognóstico e preditivo.
Estadiamento TNM – Sobrevida em 5 anos
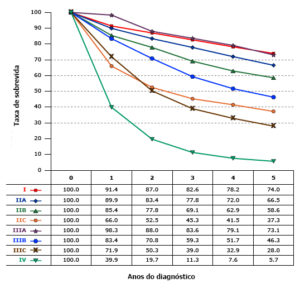
Tem acurácia de 65%. Falha principalmente no estágio II (30% a 70%) e III (30% a 50%).
Gerenciamento pré-operatório na cirurgia colorretal
Educação do paciente
O paciente submetido a um procedimento colorretal eletivo deve receber informações gerais sobre os cuidados, que incluem preparação pré-operatória, internação hospitalar, período pós-operatório em casa e tempo total de recuperação.
A melhor prática é entregar ao paciente um resumo por escrito dessas informações. No início, o cirurgião deve informar os objetivos da cirurgia proposta. O tipo de corte, a tamanho das feridas e a anatomia envolvida e os vários aspectos da cicatrização das feridas.
Se a cirurgia será laparoscópica minimamente invasiva ou aberta. Discutir possíveis complicações. Abrir espaços para o paciente fazer perguntas sobre potenciais riscos da cirurgia, o resultado esperado, e qualquer terapia alternativa. Discutir sobre a dor no pós-operatório tranquilizará o paciente e que a presença dor não é, por si só, indicação de que algo deu errado. Ao mesmo tempo, o paciente deve ter certeza de que todos os esforços serão feitos para minimizar a sua dor com o uso adequado de analgésicos.
Expectativas realistas deve ser dada sobre os resultados funcionais após as cirurgias colorretais “reconstrutiva”, tais como procedimentos que envolva anastomoses de íleo-anal, coloanal e reparação do esfíncter anal. Se houver possibilidade de ostomia, o envolvimento de uma enfermeira e de uma assistência de ostomia é extremamente útil.
O paciente deve ter certeza de que todas as medidas serão tomadas para promover um curso pós-operatório sem intercorrências. Ao mesmo tempo, o paciente precisará cooperar com os cuidados pós-operatórios, especialmente no que diz respeito aos cuidados pulmonares e movimentação precoce. Finalmente, todos os aspectos das atividades diárias pertinentes à recuperação devem ser discutidos.
Avaliação e otimização de Risco Cirúrgico
As recomendações para cirurgia colorretal eletiva são baseadas em uma história clínica apropriada, exame físico e avaliação diagnóstica. Antes de qualquer cirurgia colorretal eletiva, o paciente deve ser avaliado e preparado com cuidado.
Atenção especial deve ser dada à exposição prévia a agentes anestésicos e medicamentos e a alergias, hábitos pessoais (abuso de álcool e drogas) e doenças sistêmicas concomitantes. O risco cirúrgico é avaliado nas seguintes áreas: função cardiovascular, função pulmonar, estado renal, função hepática, estado hematológico, estado nutricional, obesidade, idade e estado psicológico.
Estado cardiovascular
Pacientes com histórico de infarto do miocárdio são propensos a sofrer outro infarto durante ou após operações subsequentes. Nos primeiros 3 a 6 meses após um infarto do miocárdio, as taxas de reinfarto são muito maiores. Após 6 meses, as taxas de reinfarto e mortalidade diminuem bastante. Senso assim, é melhor agendar uma operação eletiva 6 meses ou mais após um infarto anterior.
Alguns medicamentos podem interferir na anestesia. Diuréticos podem diminuir o potássio. Quando abaixo de 3 mEq/L devem ser corrigidas antes da operação. Interações entre os antagonistas beta-adrenérgicos e anestésicos pode resultar em bradicardia, hipotensão e insuficiência cardíaca congestiva. Ao preparar pacientes com hipertensão, disfunções associadas, como nefropatia e insuficiência cardíaca, devem ser controladas.
Se a pressão arterial está normal com medicamentos, esses devem ser continuados até o momento da cirurgia, porque são raras as complicações devido à interação entre anti-hipertensivos e agentes anestésicos.
Avaliação do estado cardiovascular é especialmente importante quando um procedimento laparoscópico colorretal é considerado.
Função pulmonar
A função pulmonar de pacientes com doença pulmonar obstrutiva crônica (bronquite ou enfisema) pode se deteriorar ainda mais como resultado de depressão ventilatória e distúrbios da perfusão ventilação durante a anestesia.
Além disso, no pós-operatório a diminuição da respiração (ventilação), devido ao efeito residual do anestésico, decúbito e dor da ferida operatória dolorosa pode resultar em complicações pulmonares, tais como a retenção de secreções, atelectasia e infecção pulmonar. Pacientes com doença pulmonar obstrutiva crônica significativa podem se beneficiar da admissão para preparação pulmonar antes da operação.
O exame pré-operatório: radiografias de tórax, medições de gases no sangue arterial e testes de função pulmonar (espirometria). Exercícios respiratórios, drenagem postural, terapia de inalação com um agente mucolítico ou broncodilatador e administração de corticosteróides podem ser úteis para melhorar a função respiratória.
Pacientes com doença respiratória crônica também estão em maior risco durante a cirurgia colorretal laparoscópica.
Estado Renal
Os pacientes com insuficiência renal têm um risco maior de complicações intraoperatórias e pós-operatórias, especialmente se está associada com hipertensão, anemia grave e alterações nos eletrólitos. Felizmente, toleram bem a anemia crônica de origem renal e não é uma contraindicação para anestesia e cirurgia. As drogas anestésicas, que são inteiramente dependentes do rim para eliminação e agentes nefrotóxicos são contraindicados.
Os pacientes em diálise podem precisar ser agendados no dia seguinte à diálise ambulatorial, com os tratamentos subsequentes realizados durante a internação. Obviamente, drogas nefrotóxicas (por exemplo, antibióticos) devem ser usadas com maior cautela nesses pacientes.
Função hepática
Embora os anestésicos intravenosos (IV) e os analgésicos narcóticos sejam amplamente eliminados pelo fígado, a desintoxicação e excreção desses agentes ainda é adequada na maioria dos pacientes com doença hepática, a menos que os danos no fígado sejam graves.
Atenção especial deve ser dada às anormalidades bioquímicas como aumento das bilirrubinas, diminuição da albumina e níveis elevados de enzimas hepáticas e amônia.
Atenção deve ser direcionada para a correção de distúrbios eletrolíticos, como hiponatremia (sódio) dilucional em pacientes com ascite e hipocalemia (potássio) devido à perda urinária excessiva.
Em muitos pacientes, a doença hepática crônica está associada a anemia causada por hemólise ou sangramento intestinal. Pode ocorrer trombocitopenia (plaquetas baixas) causada por hiperesplenismo secundário à hipertensão portal, além da diminuição dos níveis dos fatores de coagulação II, V, VII, IX e X. Ambas as anormalidades resultam em uma coagulopatia, que deve ser corrigida por transfusão de plaquetas e administração de plasma fresco congelado.
Estado Hematológico
Na anemia, para manter o fornecimento adequado de oxigênio, o débito cardíaco aumenta. No entanto, muitos pacientes anêmicos toleram muito bem uma cirurgia, a menos que apresentem um distúrbio sistêmico concomitante.
Além disso, em muitos pacientes admitidos para cirurgia colorretal, uma baixa concentração de hemoglobina pode ser a manifestação da própria doença subjacente e a intervenção proposta pode ser curativa.
Embora seja recomendado corrigir a anemia antes da cirurgia quando a hemoglobina está abaixo de 10 g, muitos pacientes com valores mais baixos tolerarão a cirurgia. Embora arbitrários, os intervalos cirurgicamente aceitáveis para o hematócrito são de 29 a 57% para homens e 27 a 54% para mulheres, e o leucócitos entre 2.400 a 16.000 mm para homens e mulheres.
Obesidade
A obesidade pode estar associada a anormalidades endócrinas, hipertensão, insuficiência cardíaca, capacidade residual funcional menor que o normal e outras complicações. Portanto, para pacientes marcadamente obesos, os estudos de gasometria arterial e função pulmonar e o exame de disfunção endócrina devem fazer parte da avaliação pré-operatória. Como o paciente obeso apresenta um risco aumentado de complicações pós-operatórias, como trombose venosa profunda (TVP), embolia pulmonar e insuficiência respiratória, são necessárias medidas pré e pós-operatórias adequadas para minimizar essas complicações. Tais medidas são efetivas apenas em paciente que estão dispostos a cooperar.
Idade
Na avaliação do risco operatório, a idade é outro aspecto que precisa ser levado em consideração. Na admissão, pacientes mais velhos frequentemente apresentam distúrbios sistêmicos concomitantes e nutrição inadequada. Como já mencionado, ambos os fatores têm um impacto negativo na morbimortalidade intra e pós-operatória.
A idade sozinha, no entanto, não é uma contra indicação para a cirurgia. No entanto, em um paciente idoso com capacidade abaixo do ideal, o cirurgião pode, por exemplo, modificar a cirurgia para uma menos agressiva.
Estado fisiológico
A maioria dos pacientes que tem uma cirurgia indicada ficará ansiosa. Às vezes, o grau de ansiedade será desproporcional à magnitude do tratamento esperado. Por exemplo, pode ser indicada uma operação anal quando ele ou ela esperava um simples comprimido ou creme para resolver o problema.
O paciente pode estar procurando ajuda para hemorroidas e, após o exame, o problema ser um câncer de reto para o qual uma cirurgia grande porte é indicada. Essa última situação exigirá considerável mudança no estilo de vida devido ao provável estoma, juntamente com possíveis outras complicações, como a impotência.
Explicar bem as expectativas da cirurgia, tais como a duração da hospitalização e tempo estimado fora do trabalho, bem como a garantia de que o paciente poderá retornar ao seu antigo tipo de trabalho, pode acalmar em muito o paciente confrontado com este diagnóstico totalmente inesperado.
Avaliação e Otimização Nutricional
O estado nutricional tem influência significativa na recuperação pós-operatória. Além disso, a desnutrição é comum, com taxas relatadas de até 50% em certas populações de pacientes hospitalizados. A avaliação nutricional identifica os pacientes em risco. Começa com um histórico de ingestão nutricional e peso. A desnutrição moderada ou grave está associada à perda de peso corporal > 10% dentro de 6 meses e a um índice de massa corporal (IMC) abaixo de 18,5 a 22 kg/m2.
O exame físico em pacientes com perda de gordura ou músculo identifica uma baixa espessura das dobras cutâneas do tríceps e uma circunferência muscular média das axilas diminuída. Outros critérios incluem parâmetros bioquímicos, como anemia, baixo nível sérico de albumina (<35 g / L), baixo nível sérico de transferrina e deficiências de vitaminas, minerais e oligoelementos.
O suporte nutricional deve ser indicado para pacientes desnutridos que necessitam cirurgia ou para pacientes saudáveis submetidos a cirurgias de grande porte com um tempo de recuperação prolongado para retornar à função gastrointestinal normal; no entanto, não está claro quando é apropriado intervir.
Vários estudos demonstraram que 7 a 10 dias de nutrição parenteral pré-operatória melhoram o resultado pós-operatório em pacientes com desnutrição grave que não podem ser adequadamente alimentados por via oral ou enteral. Por outro lado, seu uso em pacientes bem nutridos ou levemente desnutridos está associado a nenhum benefício ou a um aumento da morbidade.
A nutrição parenteral pós-operatória é recomendada em pacientes que não conseguem atender às suas necessidades calóricas em 7 a 10 dias por via oral ou enteral.
Em pacientes que necessitam de nutrição artificial pós-operatória, a alimentação enteral ou uma combinação de alimentação enteral e suplementar com a parenteral é a primeira escolha.
Atualmente, o programa se concentra em quatro áreas: nutrição, controle glicêmico, cessação do tabagismo e medicamentos. Para rastreio nutricional, quatro perguntas são feitas: O IMC do paciente é inferior a 19? O paciente teve perda de peso não intencional superior a 4 kg nos últimos 3 meses? O paciente tem pouco apetite – come menos da metade ou menos de duas refeições por dia? O paciente não consegue ingerir alimentos por via oral? Se alguma dessas perguntas for afirmativa, o paciente pode ser encaminhado para avaliação por um nutricionista ou considerado para terapia nutricional.
Albumina sérica para pacientes submetidos a cirurgia complexa. Glicemia de jejum: pacientes com diabetes, idade> 45 ou IMC> 30.
Medicamentos
Medicamentos como a varfarina, clopidogrel, e Ácido Acetilsalicílico são documentados com atenção especial para pacientes com riscos de sangramento. Beta-bloqueadores.
Testes laboratoriais
Estudos laboratoriais de rastreamento devem ser considerados antes de um grande procedimento cirúrgico. No passado, vários estudos eram rotineiramente pedidos.
Atualmente, na ausência de sintomas ou doença que exigem avaliação, os estudos listados são recomendados. Table 5.2 Preoperative laboratory evaluations
| Idade | Homem | Mulher |
| < 40 | Nenhum exame de laboratório | Hemoglobina e hematócrito |
| >40 | ECG | ECG |
Raios-X do tórax
Radiografias de tórax de rotina no pré-operatório e na admissão não são recomendadas, exceto se houver suspeita de doença cardiopulmonar aguda com base na história e no exame físico ou se houver uma história de doença cardiopulmonar crônica estável em um paciente idoso (mais de 70 anos) sem uma radiografia de tórax recente nos últimos 6 meses.
Tratamento – cirurgia curativa
A cirurgia é a única forma de tratamento com possibilidade curativa. Compreende a remoção completa do tumor primário, órgãos e estruturas localmente comprometidas e de metástases identificadas, observados os preceitos técnicos oncológicos.
Preceitos Técnicos Oncológicos
1. Margem distal livre de infiltração neoplásica superior a 1,5 a 2,0 cm no câncer de reto.
2. Ligadura alta do mesocólon, próximo à origem da artéria principal que nutre o segmento ressecado, com o objetivo de retirar o maior número possível de linfonodos.
3. Ressecção completa em monobloco na suspeita de comprometimento de órgãos e/ou estruturas vizinhas à lesão.
4. A retirada dos ovários é considerada apenas em mulheres na menopausa.
5. Aproximadamente 50% dos pacientes com câncer colorretal desenvolvem metástase à distância (estagio IV) no decorrer da doença, ou seja, quando no diagnóstico ou nos meses ou anos que se segue ao tratamento. Geralmente os pacientes com doença em estágio IV (metástase à distância) detectados na avaliação inicial não preenchem os preceitos técnicos oncológicos para a cirurgia curativa. A cirurgia paliativa é realizada nas complicações não controladas clinicamente: obstrução intestinal, hemorragia ou outras complicações.
Exceções de pacientes em estágio IV (metástase à distância) com possibilidade de cirurgia curativa:
Metástase hepática
Presente no diagnóstico em 15% a 20% e surge após o tratamento considerado curativo em meses a anos em 15% a 20%. Em 1/3 é a única metástase envolvida, mas apenas 10% a 15% são ressecáveis com sobrevida de 5 anos em 20% a 40% quando existe 3 ou menos lesões, tumores extra-hepáticos não demonstráveis e quando poder obter uma margem livre de tumor de pelo menos 1 cm. Tratamento paliativo e sintomático tem sobrevida média de 6 a 8 meses.
Algumas medidas podem tornar pacientes incialmente considerados irressecáveis em ressecáveis:
»» A quimioterapia pode diminuir as metástases, aumentando a taxa de ressecabilidade quando cerca de 13% tornam-se ressecáveis;
»» Embolização da veia porta percutânea do parênquima a ser ressecado: hipertrofia do restante perfundido, pode ser usado quando a estimativa remanescente for < 35%, para evitar insuficiência hepática pós-op. Estabilização da hipertrofia em 4 a 6 semanas. Cerca de 20% tornam-se ressecáveis;
»» Hepatectomias em dois estágios: metástase nos dois lobos, impossíveis de ser retirados de uma vez. Primeiro estágio: retira-se o maior número possível de lesões quando se segue a hipertrofia do restante e 3 semanas após realiza-se quimioterapia sistêmica (para não interferir na regeneração). Segundo estágio: apenas quando for curativa pelos critérios acima em 3 a 6 meses;
»» Hepatectomia de repetição: 60% a 70% recidivam e 1/3 é limitada ao fígado. Mesmo tecnicamente mais difícil, têm-se o ganho na sobrevida.
Metástase Pulmonar
Sítio extra-abdominal mais comum. A ressecção, embora indicada, é vista com cautela.
Ocorre em 10% a 20% e apenas 10% são isoladas, então 1% a 2% são candidatos à cirurgia.
Para a maioria o tumor passa pelo fígado e atinge o pulmão, mas o reto pode metastizar diretamente.
RX tórax com alterações variáveis: geralmente nódulos periféricos bem delimitados, bilaterais e vistos apenas quando maiores de 10 mm. A tomografia computadorizada multislice do tórax diagnostica nódulos de 2 a 3 mm.
A cirurgia é a única forma de tratamento com possibilidade curativa:
»» Critérios: tumor primário controlado sem outras metástases e lesões passíveis de ressecção cirúrgica completa pela tomografia computadorizada com parênquima restante suficiente.
»» Cirurgia: são lesões periféricas possibilitando ressecções em cunha com margem de 1 a 2 cm ou segmentectomias ou lobectomias para lesões maiores ou centrais.
Sobrevida de 5 anos de 30% a 40% nos pacientes selecionados.
Cirurgia por Localização do Câncer Colorretal
A extensão da ressecção colônica incluindo os linfonodos regionais é definida pela localização do tumor no cólon e reto baseando-se na anatomia da irrigação sanguínea.
Cirurgias para o câncer colorretal. Colectomia direita com anastomose ileocólica.
A colectomia direita é o procedimento cirúrgico para pacientes com câncer entre o ceco e cólon ascendente.
Colectomia transversal com anastomose do cólon ascendente e descendente.
A colectomia transversal é realizada para os tumores no cólon transverso. A artéria cólica média é ligada. O cólon ascendente e o cólon descendente são anastomosados.
Colectomia direita estendida com anastomose ileocólica.
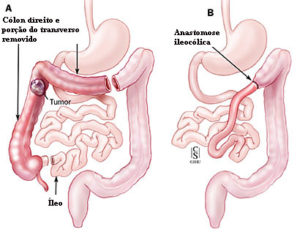 Colectomia direita estendida é realizada nos casos em que o câncer está localizado no cólon direito proximal até no cólon transverso médio. Isto requer a remoção do íleo terminal, ceco, cólon ascendente, curvatura hepática e uma parte do cólon transverso. O íleo terminal e o cólon transverso distal são anastomosados.
Colectomia direita estendida é realizada nos casos em que o câncer está localizado no cólon direito proximal até no cólon transverso médio. Isto requer a remoção do íleo terminal, ceco, cólon ascendente, curvatura hepática e uma parte do cólon transverso. O íleo terminal e o cólon transverso distal são anastomosados.
Hemicolectomia esquerda com anastomose cólon transverso e sigmóide.
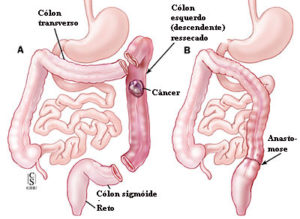 Hemicolectomia esquerda é o procedimento para os tumores do cólon descendente. A artéria cólica esquerda é ligada, a flexura esplênica e cólon descendente removido e o cólon transverso distal e o sigmóide superior são anastomosados.
Hemicolectomia esquerda é o procedimento para os tumores do cólon descendente. A artéria cólica esquerda é ligada, a flexura esplênica e cólon descendente removido e o cólon transverso distal e o sigmóide superior são anastomosados.
Colectomia sigmóide com anastomose do cólon descendente reto e superior.
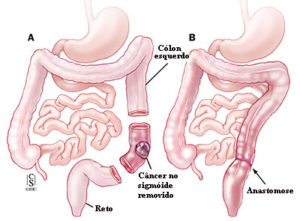 Colectomia do sigmóide (simgmoidectomia) remove tumores do cólon sigmóide. O reto superior e o cólon descendente são anastomosados.
Colectomia do sigmóide (simgmoidectomia) remove tumores do cólon sigmóide. O reto superior e o cólon descendente são anastomosados.
Colectomia subtotal com anastomose ileorretal
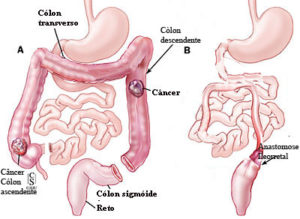 Colectomia total ou subtotal na presença de câncer colorretal sincrônicos (simultâneos), desde que as condições clínicas do paciente permitam. A incidência de câncer colorretal sincrônicos (simultâneos) varia de 1,5 a 8%. Esta variação se deve à falta de uniformidades de critérios diagnósticos e a diferenças na população estudada.
Colectomia total ou subtotal na presença de câncer colorretal sincrônicos (simultâneos), desde que as condições clínicas do paciente permitam. A incidência de câncer colorretal sincrônicos (simultâneos) varia de 1,5 a 8%. Esta variação se deve à falta de uniformidades de critérios diagnósticos e a diferenças na população estudada.
Cirurgia para o câncer de reto
O tratamento cirúrgico do câncer de reto pode ser particularmente complicado, dependendo da localização do tumor. Há uma variedade de procedimentos cirúrgicos que estão disponíveis para os doentes com câncer de reto e variam de excisão local à amputação abdominoperineal radical. O estadiamento pré-operatório preciso determinando a distância do esfíncter anal, a profundidade de invasão da parede do reto e o comprometimento ou não de linfonodos é essencial na escolha do procedimento cirúrgico adequado. A ressonância magnética e ultrassom endorretal são os principais exames diagnósticos utilizados para o estadiamento do tumor.
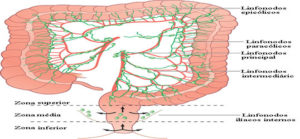 As três opções para a gestão dos casos do câncer do reto incluem excisão local, a ressecção anterior baixa com anastomose coloanal ou colorretal e a amputação abdominoperineal radical com colostomia terminal definitiva.
As três opções para a gestão dos casos do câncer do reto incluem excisão local, a ressecção anterior baixa com anastomose coloanal ou colorretal e a amputação abdominoperineal radical com colostomia terminal definitiva.
A técnica operatória de excisão total do mesorreto está sempre recomendada nas lesões localizadas no terço médio e inferior do reto.
Naqueles pacientes, quando a técnica oncológica é factível, deve-se sempre tentar a preservação nervosa, enquanto que a dissecção linfonodal lateral (ilíacos) não é recomendável na rotina.
A extensão da ressecção do reto deve ser definida pela localização do tumor e pela possibilidade de invasão loco-regional. Já o tratamento cirúrgico deverá ser, sempre que possível, realizado na tentativa da preservação esfincteriana.
Sempre que houver invasão esfincteriana pela lesão tumoral ou margem distal insuficiente, faz-se obrigatório uma cirurgia de amputação abdominoperineal.
Excisão local – Ressecção transanal
É ocasionalmente usada para terapia local em casos selecionados: tumores pequenos (menos de 3-4 cm de diâmetro), localizado de 6 cm a 8 cm da margem anal e com o envolvimento circunferencial limitada a menos de um terço da circunferência retal.
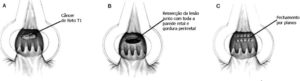 O tumor deve ser moderado ou bem diferenciado e ser T1 na ultrassonografia transretal ou não ressonância magnética. O ideal e obter uma margem de 1 cm de mucosa macroscopicamente normal além da borda do tumor, apesar de 5 mm ser aceitável. É ressecada toda a parede retal junto com gordura perirretal. A ressecção transanal local reduz as complicações perioperatórias e preserva as funções urinárias, anorretal e sexual. Estudos demonstram taxa de sobrevivência de 90% em 5 anos livre de recidiva em pacientes com tumor retal T1 bem ou moderadamente diferenciados, sem invasão venosa ou linfática.
O tumor deve ser moderado ou bem diferenciado e ser T1 na ultrassonografia transretal ou não ressonância magnética. O ideal e obter uma margem de 1 cm de mucosa macroscopicamente normal além da borda do tumor, apesar de 5 mm ser aceitável. É ressecada toda a parede retal junto com gordura perirretal. A ressecção transanal local reduz as complicações perioperatórias e preserva as funções urinárias, anorretal e sexual. Estudos demonstram taxa de sobrevivência de 90% em 5 anos livre de recidiva em pacientes com tumor retal T1 bem ou moderadamente diferenciados, sem invasão venosa ou linfática.
Ressecção Anterior Baixa.
É indicada para as lesões localizadas nos dois terços superiores do reto. Nesta cirurgia o esfíncter anal pode ser poupado com realização da anastomose coloanal baixa no nível do assoalho pélvico.
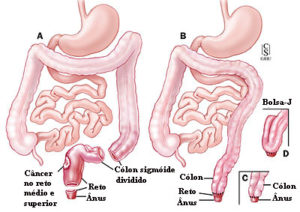 A- Ressecção anterior baixa;
A- Ressecção anterior baixa;
B e C- anastomose coloanal;
D- construção de bolsa em J criando um reservatório.
Anastomose colorretal ou reconstruções coloanal são alternativas para a colostomia permanente. A construção de uma bolsa colônica em J cria um reservatório neorretal que pode reduzir a frequência e urgência de evacuações e evacuações noturnas em casos selecionados.
Esta ressecção radical “transabdominal” é recomendada para a maioria dos cânceres com risco de recorrência local (superior ao estágio T1 ou pouco diferenciado ou com metástase linfática). A seleção de procedimento cirúrgico deve ser orientada para a prevenção da recidiva pélvica. Excisão total do mesorreto com uma ressecção anterior baixa ou uma amputação abdominoperineal são os procedimentos cirúrgicos ideais para o câncer retal.
A excisão total mesorreto remove o mesentério retal como uma unidade intacta. Isso reduz a recorrência local, juntamente com a preservação da função sexual, função urinária e continência fecal.
Amputação Abdominoperineal.
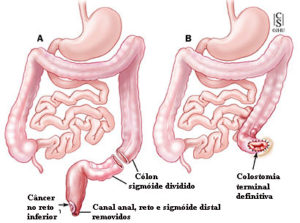 É usada quando a lesão é na parte mais baixa do reto, tipicamente envolvendo o esfíncter anal ou margem distal insuficiente de 1,5 a 2,0 cm. Uma colostomia terminal definitiva permite a drenagem dos resíduos fecais através de uma abertura na parede abdominal. Amputação abdominoperineal:
É usada quando a lesão é na parte mais baixa do reto, tipicamente envolvendo o esfíncter anal ou margem distal insuficiente de 1,5 a 2,0 cm. Uma colostomia terminal definitiva permite a drenagem dos resíduos fecais através de uma abertura na parede abdominal. Amputação abdominoperineal:
A- ressecção do ânus, reto e sigmóide distal;
B- colostomia definitiva
Cirurgia de urgência para obstrução e/ou perfuração
Em determinadas circunstâncias que correspondem a 20% de todos os casos, o paciente com câncer colorretal recebe um tratamento não planejado, em caráter de urgência ou emergência, seja por causa de obstrução (15% dos casos) seja por causa de perfuração e peritonite (5% dos casos).
Nessas situações a mortalidade chega de 20%, podendo atingir valor tão alto quanto 70% na dependência da idade e do estado geral de desnutrição do paciente, em geral seriamente comprometido por causa da eventual disseminação abdominal do câncer ou infecção generalizada da perfuração com peritonite e, também, porque a solução tem um tratamento em caráter de emergência.
Descompressão colonoscópica
O câncer colorretal é responsável por cerca de 1/3 dos casos de obstrução localizadas no cólon esquerdo e reto. Historicamente, a mortalidade operatória na obstrução intestinal é maior do que na cirurgia eletiva e recentemente focalizou-se atenção na descompressão do cólon antes da cirurgia transformando o paciente agudo em um eletivo e possibilitando a ressecção com anastomose primária. Diagnóstico pelo quadro clínico e radiológico – enema com contraste hidrossolúvel, sempre excluindo os casos de perfuração.
Nos pacientes portadores de câncer colorretal irressecável (carcinomatose peritoneal, múltiplas metástases à distância, recorrência local com extensa infiltração e risco cirúrgico proibitivo) opta-se pelo tratamento paliativo. Preferência para a simples ressecção do tumor com anastomose primária, quando não factível e encontra-se disponível, pode-se optar pelo tratamento endoscópico paliativo com o uso de STENT.
Descompressão com Cateter
Preparo colônico via retal com clister glicerinado.
Introdução de um cateter através da obstrução guiado por um fio guia metálico sob controle radiológico. Lelcuk em 1986 usou em três pacientes com sucesso e por Rattan em 1989 com sucesso em seis de nove pacientes. Todos com obstrução baixa (retossigmóide).
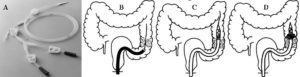 A- Cateter; B- Passagem do fio guia metálico sob controle radiológico por colonoscopia; B- Passagem do cateter sob o fio guia além da obstrução, ponto marcado com injeção de contraste na margem distal do tumor; C- insuflação do balão seguido da lavagem e drenagem da porção do cólon proximal a lesão descomprimindo o cólon.
A- Cateter; B- Passagem do fio guia metálico sob controle radiológico por colonoscopia; B- Passagem do cateter sob o fio guia além da obstrução, ponto marcado com injeção de contraste na margem distal do tumor; C- insuflação do balão seguido da lavagem e drenagem da porção do cólon proximal a lesão descomprimindo o cólon.
Descompressão com Stent
Preparo colônico via retal com clister glicerinado.
O stent consiste em uma prótese de metal auto expansiva (10 a 12 cm x 23 mm). É colocada com o auxílio do colonoscópio e da fluoroscopia (RX – intensificador de imagem).
1- Na obstrução completa pode-se usar o cateter biliar de 5F e contrastar a porção proximal da obstrução e avaliar a sua extensão.
2- Pode-se usar ou não um dilatador, antes de se colocar o stent.
3- Realiza-se a injeção de contraste hidrossolúvel na margem proximal do tumor para marcar a extremidade distal do stent.
4- Passa-se o guia metálico através e além do tumor e sobre ele o cateter com o stent.
5- Complicações: migração do stent (mais freqüente) e a perfuração.
Apesar do número pequeno de casos, o STENT tem se tornado o tratamento de primeira linha para se evitar procedimentos cirúrgicos de urgência em pacientes totalmente obstruídos.
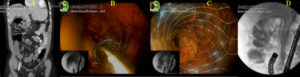 A- TC com obstrução cólon esquerdo; B- Colocando o stent pela colonoscopia sob controle radiológico; C- Stent bem posicionado, visão pela colonoscopia; D- Stent bem posicionado, visão radiológica.
A- TC com obstrução cólon esquerdo; B- Colocando o stent pela colonoscopia sob controle radiológico; C- Stent bem posicionado, visão pela colonoscopia; D- Stent bem posicionado, visão radiológica.
Quando os procedimentos de descompressão não estão disponíveis ou falham, resta a cirurgia como tratamento. Pode ser em um tempo (todos os procedimentos cirúrgicos são realizados em uma única cirurgia) ou em dois tempos (primeira cirurgia apenas para retirar o paciente da urgência).
Cirurgia em um tempo
Colectomia oncológica do segmento com o câncer seguido de anastomose primária. Possível na inexistência de choque séptico com ou sem perfuração com peritonite e/ou condições clínicas pregressas e graves (insuficiência cardíaca, renal, hepática, pulmonar, etc.).
É necessário fazer o preparo intra-operatório do cólon, método simples e seguro. Feita a laparotomia, todo o cólon é liberado, inclusive o ângulo hepático e esplênico, posicionando-o na superfície do campo operatório. Todos os tempos da retossigmoidectomia anterior são realizados, respeitando-se os princípios oncológicos; imediatamente antes da retirada da peça, inicia-se o preparo.
Incisão transversal na parede do apêndice por onde é introduzida e fixada uma sonda de Foley nº 22. A sonda é conectada a um equipo de um frasco de soro, por onde se infunde solução fisiológica a 37°C. Para evitar refluxo para o intestino delgado, é colocada uma pinça no íleo terminal. Proximamente ao tumor o conteúdo fecal é empurrado em sua direção. Imediatamente acima se realiza uma incisão transversa na parede anterior do cólon, por onde é introduzido um tubo plástico sanfonado (traqueia do respirador) fixado ao cólon através de duas ligaduras e, sua porção distal, inserida em um balde fora do campo operatório com uma coluna de água, constituindo um sistema fechado. Realiza-se a lavagem do cólon até a saída de líquido claro pelo tubo plástico. Em geral dois a quatro litros de soro fisiológico morno são necessários. Uma vez considerada a limpeza completa, o cólon é seccionado acima da abertura, a peça e o dispositivo de lavagem são retirados. Realiza-se a seguir a apendicectomia. A anastomose intestinal é realizada.
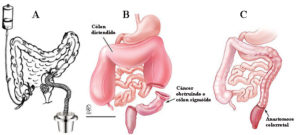
A- Preparo intra-operatório;
B- Ressecção do segmento com o câncer obstrutivo; C- Anastomose intestinal primária
Cirurgia em 2 tempos a Hartmann.
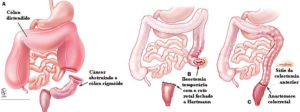 Consiste da ressecção de segmento colônico com câncer colorretal obstrutivo sem anastomose primária, com fechamento do coto distal e abertura de colostomia proximal ao segmento ressecado. Cirurgia a Hartmann:
Consiste da ressecção de segmento colônico com câncer colorretal obstrutivo sem anastomose primária, com fechamento do coto distal e abertura de colostomia proximal ao segmento ressecado. Cirurgia a Hartmann:
A – Ressecção anterior baixa com colostomia temporária, B – Anastomose colorretal subsequente; C – Restauração da continuidade do trato GI.
Cirurgia em 2 tempos com colostomia próximo ao tumor.
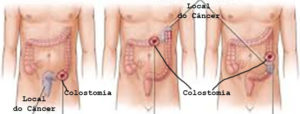
Nos pacientes gravemente enfermos pode-se optar pela realização da colostomia em alça proximalmente a lesão dentro do segmento a ser removido (1º tempo) na colectomia (2º tempo).
Cirurgia em 2 tempos com colostomia em alça no cólon transverso através de pequena incisão no hipocôndrio direito.
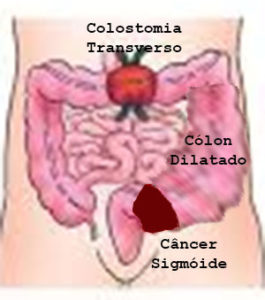
A descompressão com menor trauma cirúrgico possibilita a melhora clínica do paciente para a colectomia do segmento com o câncer seguido da anastomose primária e fechamento da colostomia.
Ressecção Transanal
É ocasionalmente usada para terapia local em casos selecionados: tumores pequenos (menos de 3-4 cm de diâmetro), localizado de 6 cm a 8 cm da margem anal e com o envolvimento circunferencial limitada a menos de um terço da circunferência retal.
O tumor deve ser moderado ou bem diferenciado e ser T1 na ultrassonografia transretal ou não ressonância magnética. O ideal e obter uma margem de 1 cm de mucosa macroscopicamente normal além da borda do tumor, apesar de 5 mm ser aceitável. É ressecada toda a parede retal junto com gordura perirretal. A ressecção transanal local reduz as complicações perioperatórias e preserva as funções urinárias, anorretal e sexual. Estudos demonstram taxa de sobrevivência de 90% em 5 anos livre de recidiva em pacientes com tumor retal T1 bem ou moderadamente diferenciados, sem invasão venosa ou linfática.
Cirurgia Convencional e Videolaparoscópica
Cirurgia aberta convencional
Na colectomia convencional ou aberta, o cirurgião realiza geralmente uma extensa incisão mediana no abdome (laparotomia) para a exposição do intestino, a fim de proceder a cirurgia. A recuperação é mais longa com maior tempo de hospitalização e maior tempo de afastamento do trabalho.
Colectomia por Videolaparoscopia
É a realização da mesma cirurgia convencional, isto é, a retirada do mesmo segmento colônico com o câncer e linfonodos que seriam ressecados pela via convencional. Por um corte (1,0-2,0 cm) introduz uma cânula por onde se passa uma ótica com a vídeo câmera. Este aparelho gera a imagem do interior do abdome num monitor de TV de alta definição. Geralmente realizam-se outros 03 corte aonde através de outras cânulas introduz instrumentos para realizar a cirurgia. Posteriormente, alarga-se um destes cortes para 4-6 cm para permitir a retirada do intestino com ou sem anastomose (religação do intestino) conforme o caso. Pode ser necessária a realização de colostomia (intestino ligado à parede abdominal) temporária e protetora quando a anastomose for muito baixa (reto ou canal anal) ou definitiva (amputação abdominoperineal.
Colectomia aberta versus laparoscópica
Estudos demonstraram recuperação mais rápida, sem impacto prejudicial na recorrência ou na sobrevivência da laparoscopia em comparação com a colectomia aberta para o tratamento do câncer de cólon. Assim, quando um cirurgião experiente em técnicas avançadas de colectomia laparoscópica está disponível, recomendamos a colectomia assistida por laparoscopia, em vez da colectomia aberta, para pacientes com câncer de cólon localizado sem complicações e que nunca tiveram cirurgia abdominal extensa prévia. Para cânceres de cólon complicados, uma abordagem aberta é frequentemente necessária.
O paciente realiza os mesmos exames pré-operatórios e preparo intestinal da cirurgia convencional. A omissão da preparação mecânica do intestino não aumenta as morbidades cirúrgicas em pacientes submetidos a ressecções laparoscópicas do intestino. Também não afeta o tempo de operação e a taxa de conversão.
Dieta zero por via oral 06 horas antes da operação e caso fume recomenda-se parar. São prescritos antibióticos profiláticos no início da anestesia.
Pode ser necessária a conversão para a via aberta através laparotomia. Os principais fatores de conversão são: obesidade, aderência de cirurgias prévias, má visualização da anatomia, sangramento durante a operação e grandes tumores.
As complicações são as mesmas da via aberta: sangramento, infecção, fistula (vazamento na emenda do intestino), lesão de ureter e outros órgãos e embolia.
No pós-operatório deve-se atentar para: falta de ar, dor no peito, saída de pus pelo corte, febre persistente, dor abdominal crescente e inchaço no abdome. Nestes casos, você deve dirigir-se ao hospital aonde operou.
Tratamento Neoadjuvante, antes da cirurgia.
É o realizado antes da cirurgia. Inclui a radioterapia isoladamente ou acompanhada por quimioterapia: vantagens nos estadios II e III para o câncer de reto.
Tratamento Adjuvante, após a cirurgia.
É o realizado após a cirurgia. Pacientes com câncer colorretal com estadio III apresentam indicação de tratamento adjuvante com quimioterapia à base de 5 Fluorouracil. Os seguintes esquemas são recomendados:
1. 5 Fluorouracil/Leucovorin durante 6 meses (NCCTG );
2. 5 Fluorouracil/Leucovorin em altas doses semanais durante 6 meses (NSABP);
3. 5 Fluorouracil/Levamisole durante 1 ano.
Pacientes com estadio II, o tratamento adjuvante ainda é controverso, porém estudos do NSABP indicam uma redução do risco de recidiva com uma vantagem de 2% em sobrevida livre em 5 anos para os pacientes tratados com terapia adjuvante com 5 Fluorouracil, quando comparados com grupos controle sem tratamento.
Terapia Biológica
Para efetivar esse tipo de tratamento biológico, insere-se no organismo um anticorpo monoclonal criado por um Linfócito B. Ao chegar às células cancerígenas, os anticorpos monoclonais interferem no crescimento e disseminação da doença. Esse procedimento é utilizado em casos avançados de câncer. O tratamento biológico pode ser realizado em conjunto com outros tipos de tratamentos como a quimioterapia. Esse método é geralmente adotado em casos mais severos da doença e pode gerar fortes efeitos colaterais.
O tratamento para pacientes com estadio IV é baseado em quimioterapia com objetivo paliativo. É considerado padrão o uso do 5-FU combinado ou não com leucovorin, demonstrando-se aumentos variáveis de sobrevida. Irinotecan (CPT-11) é considerado hoje como terapia padrão em associação ao 5-Fluorouracil e leucovorin para pacientes com doença estádio IV, e para aqueles que não respondam ou apresentam progressão pós-tratamento com fluoropirimidinas (irinotecan isoladamente).
Oxaliplatina, sozinho ou em combinação com 5 Fluorouracil/leucovorin, tem demonstrado atividade promissora em pacientes com câncer colorretal metastático previamente tratados ou virgens de tratamento e em pacientes com doença refratária ao 5 Fluorouracil.
Acompanhamento após o tratamento do câncer colorretal
O objetivo principal do acompanhamento do câncer colorretal é a detecção precoce do câncer que retornou após o tratamento. O acompanhamento do câncer colorretal inclui exames físicos regulares, testes de antígeno carcinoembrionário (CEA), tomografia computadorizada (TC) e colonoscopia ou retossigmoidoscopia.
A importância do acompanhamento
Após o tratamento do câncer colorretal, o acompanhamento é importante para ajudar a manter uma boa saúde, o que inclui o gerenciamento de quaisquer efeitos colaterais do tratamento e a observação de efeitos colaterais de longo prazo (chamados efeitos tardios).
A razão mais importante para os cuidados de acompanhamento, no entanto, é observar sinais de recorrência do câncer (câncer que volta após o tratamento). O acompanhamento é especialmente importante nos primeiros cinco anos após o tratamento, pois é quando o risco de recorrência é maior.
Um plano de atendimento de acompanhamento pode incluir exames físicos regulares e outros exames médicos para monitorar sua recuperação nos próximos meses e anos. Muitos sobreviventes sentem-se preocupados ou ansiosos com o retorno do câncer após o tratamento. Pessoas diferentes têm riscos diferentes de recorrência, por isso é importante conversar com seu médico sobre a possibilidade de o câncer retornar.
Recomendações para cuidados
As recomendações de acompanhamento incluídos nesta seção destinam-se principalmente a pessoas que tiveram câncer colorretal em estágio II ou III. É menos certo que teste deve ser feito para pessoas que tiveram câncer colorretal no estágio I, porque é menos provável que nesse estágio a câncer retorne.
Se você foi submetido a uma cirurgia para câncer colorretal metastático (câncer que se espalhou), é importante conversar com seu médico sobre um plano de acompanhamento específico para você, uma vez que atualmente não existe um cronograma padronizado de acompanhamento para esse estágio do câncer colorretal.
Também é importante lembrar que essas recomendações de acompanhamento são para pessoas que tiveram câncer colorretal sem síndrome hereditária.
Os testes recomendados e a programação dos testes baseiam-se no risco de recorrência e na saúde geral. Em geral, você visitará seu médico e receberá uma triagem de acompanhamento com mais frequência no início de sua recuperação, porque 80% das recorrências são encontradas nos primeiros dois a três anos após a cirurgia e 95% das recorrências são encontradas dentro de cinco anos.
Consultas e exames físicos regulares:
ᴥ» 1ª consulta: 1 a 2 semanas;
ᴥ» 2ª consulta: 1 mês;
ᴥ» Consultas a cada 3 meses nos primeiros 2 anos;
ᴥ» consultas a cada 6 meses por mais 2 anos e então anualmente.
Exames recomendados para observar a recorrência do câncer colorretal
CEA (antígeno carcinoembriogênico) – É recomendado a cada três a seis meses durante cinco anos. Este exame de sangue que detecta os níveis de proteína CEA. Altos níveis de CEA podem indicar que um câncer se espalhou para outras partes do corpo.
Tomografia computadorizada (TC) – A tomografia computadorizada do abdome e do tórax é recomendada a cada ano durante três anos. Se você tiver um alto risco de recorrência, seu médico poderá recomendar tomografias a cada seis a 12 meses nos primeiros três anos. Para o câncer de reto, a tomografia pélvica também é recomendada.
Colonoscopia – Esse teste permite ao médico procurar pólipos ou segundo câncer colorretal com um colonoscópio (um tubo flexível e iluminado). Você deve receber uma colonoscopia um ano após a cirurgia. A frequência com que você precisa desse teste depende dos resultados do teste anterior. Por exemplo, se pólipos forem encontrados, talvez seja necessário fazer outra colonoscopia mais cedo. No entanto, em geral, esse teste será realizado a cada três anos.
Retossigmoidoscopia – Neste teste, um sigmoidoscópio (um tubo flexível e iluminado) é inserido no reto do paciente para verificar pólipos, câncer e outras anormalidades. Se você teve câncer retal, mas não recebeu radioterapia na pelve, este teste é recomendado a cada seis meses. Embora a retossigmoidoscopia possa ser recomendada, mesmo que você tenha feito terapia de radiação para câncer retal, mas isso depende do risco de recorrência.
Cronograma recomendado de acompanhamento
Primeiro ano após o tratamento »» Exame físico e teste CEA a cada três a seis meses; »» Tomografia computadorizada de abdome e tórax a cada ano (a cada seis a 12 meses para pacientes com alto risco de recorrência); »» Para pacientes com câncer de reto, a TC pélvica a cada seis a 12 meses »» Colonoscopia um ano após a cirurgia; »» Retosigmoidoscopia a cada seis meses para pacientes com câncer retal que não receberam radioterapia na pelve.
Segundo ano após o tratamento »» Exame físico e teste CEA a cada três a seis meses; »» Tomografia computadorizada a cada ano (a cada seis a 12 meses para pacientes com alto risco de recorrência); »» Para pacientes com câncer retal, a TC pélvica a cada seis a 12 meses; »» Retossigmoidoscopia a cada seis meses para pacientes com câncer retal que não receberam radioterapia na pelve.
Terceiro ano após o tratamento
»» Exame físico e teste CEA a cada três a seis meses;
»» Tomografia computadorizada a cada ano (a cada seis a 12 meses para pacientes com alto risco de recorrência);
»» Para pacientes com câncer retal, a TC pélvica a cada seis a 12 meses;
»» Retossigmoidoscopia a cada seis meses para pacientes com câncer retal que não receberam radioterapia na pelve.
Quarto ano após o tratamento
»» Exame físico e teste CEA a cada três a seis meses; »» Para pacientes com câncer retal, a tomografia pélvica a cada ano;
»» Retossigmoidoscopia a cada seis meses para pacientes com câncer retal que não receberam radioterapia na pelve.
Quinto ano após o tratamento
»» Exame físico e teste CEA a cada três a seis meses;
»» Para pacientes com câncer retal, a tomografia pélvica a cada ano;
»» Retossigmoidoscopia a cada seis meses para pacientes com câncer retal que não receberam radioterapia na pelve.
O que isso significa para os pacientes
O acompanhamento regular programado ajuda a aumentar a probabilidade de encontrar uma recorrência tratável. Converse com seu médico sobre o risco de recorrência e como isso afeta sua programação de cuidados de acompanhamento. Você deve pedir ao seu médico um resumo escrito dos cuidados primários e das recomendações para o seu acompanhamento.
Além dos cuidados regulares de acompanhamento, as pessoas que se recuperam do câncer colorretal são incentivadas a seguir as diretrizes estabelecidas para uma boa saúde, como manter um peso saudável, se exercitar, não fumar, comer uma dieta equilibrada e fazer testes de rastreamento de câncer. Converse com seu médico para desenvolver um plano melhor para suas necessidades.
Perguntas a fazer ao médico
1- Qual é o meu risco de recorrência?
2- De que testes de acompanhamento precisarei e com que frequência precisarei deles?
3- Quem coordenará meus cuidados de acompanhamento?
4- Se eu mudar ou precisar mudar de médico, como posso continuar meu cronograma de acompanhamento recomendado?
5- Com que frequência precisarei de testes CEA? Onde isso será feito?
6- Com que frequência preciso de uma tomografia computadorizada? Onde isso será feito?
7- Com que frequência preciso de uma colonoscopia? Quem fará e onde será feito?
8- Com que frequência preciso de uma retossigmoidoscopia (apenas câncer retal)?
9- Quais sinais e sintomas devo prestar atenção?
10- Que tipo de assistência de acompanhamento eu preciso além de cinco anos após o tratamento?
11- Onde posso encontrar mais informações sobre os cuidados de acompanhamento?
Isenção de responsabilidade
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.